题目内容
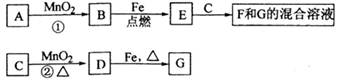
(14分)固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。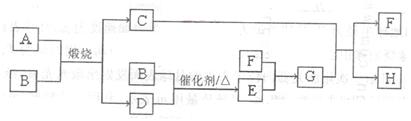
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则:
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
解析试题分析:由C为红棕色粉末,D为能使品红溶液褪色的无色气体。可知C为Fe2O3、D为SO2,B和SO2在催化剂、加热的条件下反应,故B为氧气;(1)三氧化硫和水反应生成硫酸,硫酸能溶解氧化铁,故F为水;(2)根据Fe2O3和SO2的质量比为5:8,推出Fe和S的个数比为1:2,故A为FeS2;(3)E为SO3,SO3和水反应生成硫酸,硫酸和氧化铁反应硫酸铁和水;二氧化硫具有还原性,和三价铁离子发生氧化还原反应,二氧化硫被氧化成硫酸根离子,三价铁离子被还原成二价铁离子,故离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ;(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,硫酸根离子的浓度为0.4mol/L,硫酸电离出氢离子,铁离子水解生成氢离子,故氢离子的浓度大于0.2mol/L,硫酸铁电离出的铁离子发生水解,使离子浓度减小,故c(Fe3+)<0.2mol/L,溶液呈酸性,氢氧根离子的浓度很小,故混合溶液中离子浓度为:c(SO42-)>c(H+)>c(Fe3+)>c(OH-) ;(5)①左端是阳离子交换膜,只允许阳离子通过,故左端消耗阳离子,阳离子在阴极反应,故左端为阴极,连接电源的负极,a为负极;②左端消耗阳离子氢离子,就会生成氢氧根离子,左端可以生成氢氧化钠溶液,故N处收集到氢气,右端消耗氢氧根离子,生成氢离子,阴离子硫酸根离子会移动到右端,生成硫酸,故Q口收集到的是硫酸溶液;③因为左端生成氢氧化钠溶液,右端生成硫酸溶液,故需要钠离子通过阳离子交换膜,硫酸根离子通过阴离子交换膜,故饱和溶液为硫酸钠溶液;(6)H为硫酸铁溶液,故主要是检验铁离子,可用硫氰化钾溶液,溶液变红色,注意检验溶液时,应取少量于试管中,加少量硫氰化钾溶液,现象为溶液变红色,结论是含铁离子。
考点:根据元素化合物的性质进行推断、离子浓度的比较、电极反应式的分析与判断、铁离子的检验等知识。

 阅读快车系列答案
阅读快车系列答案某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。
你认为他的解释是否合理?答:__________(填“合理”或“不合理”)
(1)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,
反应的离子方程式为 。
(2)实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
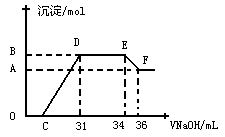
(3)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________
(4)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为__________
(5)上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(6)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为_______mL。
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用: 。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe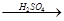 H2
H2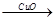 Cu ②CuO
Cu ②CuO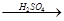 CuSO4
CuSO4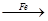 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是 。
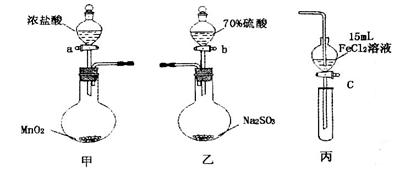
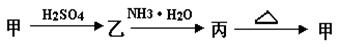
 丙转化的离子方程式 :________________________ 。
丙转化的离子方程式 :________________________ 。