��Ŀ����
������(CH3OCH3)��һ����Ҫ�����ȼ�������䴢�ˡ�ȼ�հ�ȫ�ԡ�����ȼ���¶ȵ�����ָ�������Һ��ʯ������Ҳ������ȼ�յ�ص�ȼ�ϣ����кܺõĺ�չǰ����
��1����֪H2��CO��CH3OCH3��ȼ����(��H)�ֱ�Ϊ-285.5kJ/mol��-283kJ/mol��-1460.0 kJ/mol����ҵ������ˮú���ɷְ�1:1�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ ��
��2����ҵ�ϲ��õ縡Զ���۷�������ˮʱ��������ˮ��pH��5.0��ͨ���������Fe(OH)3���壬�������������ʣ�ͬʱ��������������H2�������������ˮ�棬���ڳ�ȥ��ʵ�����Զ�����ȼ�ϵ��ģ��÷�����Ƶ�װ������ͼ��ʾ��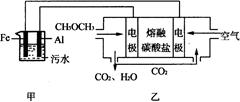
����װ��������̼����Ϊ����ʣ�ϡ����������Ϊ�缫��д����ȼ�ϵ�ص������缫��Ӧʽ ���������ʿ������������̼���ε��� ��
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
��д����װ��������������������Fe(OH)3���������ӷ���ʽ�� ��
����֪������Kap[Fe(OH)3]=4.0��10��38�����һ��ʱ���װ����c(Fe3+)= ��
����֪��H2S�ĵ���ƽ�ⳣ����K1=9.1��10��8��K2=1.1��10��12��H2CO3�ĵ���ƽ�ⳣ����K1=4.31��10��7��K2=5.61��10��11����õ缫��ת�Ƶ���Ϊ0.24molʱ������װ�������ɵ�CO2ͨ��200mL 0.2mol/L��Na2S��Һ�У����и�����ȷ����
A��������Ӧ�����ӷ���ʽΪ��CO2+S2��+H2O=CO32��+H2S
B��������Ӧ�����ӷ���ʽΪ��CO2+S2��+H2O=HCO3��+HS��
C��c(Na+)=2[c(H2S)+c(HS��)+c(S2��)]
D��c(Na+)+c(H+)=2c(CO32��)+2c(S2��)+c(OH��)
E��c(Na+)>c(HCO3��)>c(HS��)>c(OH��)
��1��3H2��g��+3CO��g����CH3OCH3��g��+CO2��g����H= ��246.4kJ/mol
��2����O2 + 4e����2CO2 ��2CO32����B
�� 4Fe2+��O2��10H2O��4Fe(OH)3����8H+
�� 4.0��10��11mol/L ��B��C��E
���������������1�����ݸ�˹���ɿ�֪����ҵ������ˮú���ɷְ�1:1�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ3H2��g��+3CO��g����CH3OCH3��g��+CO2��g����H=��246.4kJ/mol����2�����Զ�����Ϊȼ�ϵĵ�أ�ͨ��ȼ�ϵĵ缫Ϊ������ͨ��O2�ĵ缫Ϊ�����������缫��ӦʽO2 + 4e����2CO2 ��2CO32����NaHCO3��(NH4)2CO3�����ֽ⣬���Բ���������̼���ε���ʡ�MgCO3��Na2CO3�������ӻ�������Ӽ�ǰ�ߴ��ں��ߣ��ۻ���Ҫ���ĸ��������������һ����Na2CO3���������ε�صĵ���ʡ� ���ڼ�װ����Al��������Fe����������������������Ӧ��Fe-2e-=Fe2+. Ȼ������Ӧ��4Fe2+��O2��10H2O��4Fe(OH)3����8H+������4Fe(OH)3���������������������ʣ��Ӷ�ʹˮ��ó��塣���ڳ�����Kap[Fe(OH)3] ="4.0��" 10��38��pH��5.0��c(OH-)=10-9mol/L, c(Fe3+)= Kap[Fe(OH)3]�� c(OH-)3=4.0��10��38�� (10-9)3= 4.0��10��11mol/L. ���ڼ���ȼ�ϵ���еĸ��������ĵ缫��ӦΪ��:CH3OCH3+3H2O=2CO2+12e-+12H+���ɼ�ÿת��6mol�ĵ��ӣ�����1��mol��CO2���壬��ת�Ƶ���0.24mol�����Բ���CO2��������ʵ���Ϊ0.24mol��6= 0.04mol.n(Na2S)=" 0.2L��" 0.2mol/L="0.04mol." ��˽�ϵ���ƽ�ⳣ�����߷�����Ӧ�ķ�ӦΪCO2+S2��+ H2O=HCO3��+HS�������A����B��ȷ��C�����������غ�ɵ�c(Na+)=2c(S2��)(��ʼ)=2[c(H2S)+ c(HS��)+c(S2��)]����ȷ��D. ���ݵ���غ�ɵã�c(Na+)+c(H+)= 2c(CO32��)+2c(S2��)+ c(OH��)+c(HCO3����+c(HS��).����E.���ݶ���֮��ķ�Ӧ�������غ�ɵ�c(Na+)= c(HCO3��)(��ʼ)+c(HS��)(��ʼ). HCO3����HS����Ҫ����ˮ�ⷴӦ��Ҫ���ģ���Ϊ����ƽ�ⳣ��H2CO3>H2S����ĵ��볣��Խ��Խ�����룬�������ˮ��̶Ⱦ�ԽС����ˮ��̶�HCO3��<HS����ˮ��̶�Խ����Һ�и����ӵ�Ũ�Ⱦ�ԽС������c(HCO3����>c(HS��)��ˮ��ʹ��Һ�Լ��ԡ�����ˮ���ܵ���˵�Ǻ����ģ������Һ�и����ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HCO3��)>c(HS��)>c(OH��)����ȷ��
���㣺�����Ȼ�ѧ����ʽ�����ӷ���ʽ����д��ȼ�ϵ�ء����صķ�Ӧԭ��������Ũ�ȵĴ�С�Ƚϡ�

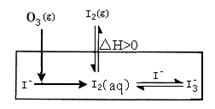
�����еIJ��ֵ�Դ��O3�Ժ�ˮ��I������������O3����ͨ��NaI��Һ�н���ģ���о���
(1)O3��I��������I2�Ĺ�����3����Ӧ��ɣ�
��I��(aq)��O3(g)=IO��(aq)��O2(g)��H1
��IO��(aq)��H��(aq) HOI(aq)��H2
HOI(aq)��H2
��HOI(aq)��I��(aq)��H��(aq) I2(aq)��H2O(l)��H3
I2(aq)��H2O(l)��H3
�ܷ�Ӧ�Ļ�ѧ����ʽΪ____________________���䷴Ӧ�Ȧ�H��__________��
(2)����Һ�д��ڻ�ѧƽ�⣺I2(aq)��I��(aq) I3��(aq)��
I3��(aq)��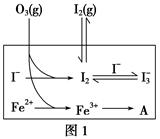
��ƽ�ⳣ������ʽΪ______________��
(3)Ϊ̽��Fe2����O3����I����Ӧ��Ӱ��(��Ӧ��ϵ��ͼ1)��ij�о�С��ⶨ����ʵ����I3��Ũ�Ⱥ���ϵpH�������ͼ2���±���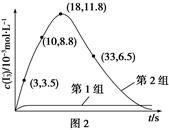 ��
��
| ��� | ��Ӧ�� | ��ӦǰpH | ��Ӧ��pH |
| ��1�� | O3��I�� | 5.2 | 11.0 |
| ��2�� | O3��I����Fe2�� | 5.2 | 4.1 |
�ٵ�1��ʵ���У����·�Ӧ��pH���ߵ�ԭ����______________________________��
��ͼ1�е�AΪ__________����Fe3������A�Ĺ������������I����ת���ʣ�ԭ����____________________________________________________________��
�۵�2��ʵ�����18 s��I3��Ũ���½��������½���ֱ��ԭ����(˫ѡ)________(����ĸ���)��
A��c(H��)��С B��c(I��)��С C��I2(g)�������� D��c(Fe3��)����
(4)��ͼ2������3��18 s�ڵ�2��ʵ��������I3����ƽ����Ӧ����(д��������̣����������λ��Ч����)��
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1���ڹ̶��ݻ����ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g�� 2NH3��g�� ��H=��92��4kJ/mol��
2NH3��g�� ��H=��92��4kJ/mol��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
���ж�K1 K2����д��>�� �� =����<������
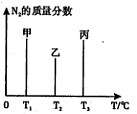
��2����2mol N2��3mol H2�ϳɰ����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䣬������������ͬ������£�ʵ���÷�Ӧ�����е�t minʱN2������������ͼ��ʾ����ʱ�ס��ҡ�������������һ���ﵽ��ѧƽ��״̬���� �����ﵽƽ��״̬ʱ��N2ת������͵��� ��
��3��NH3��CO2��120oC�����������¿��Ժϳɷ�Ӧ�������أ�CO2 +2NH3
 ��NH2��2CO +H2O
��NH2��2CO +H2O���ܱշ�Ӧ�����У����������NH3�ĺ����仯��ϵ��ͼ��ʾ
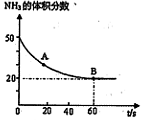
��������������Ϊ���壩����A�������Ӧ/����
 ��CO2�� B����淴Ӧ����
��CO2�� B����淴Ӧ���� ��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ��
��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ����4����֪�����Ȼ�ѧ����ʽ��
2H2��g��+O2��g��=2H2O��1�� ��H = -571��6kJ/mol
N2��g��+O2��g��
 2NO��g�� ��H =+180kJ/mol
2NO��g�� ��H =+180kJ/mol��д����NH3��ԭNO���Ȼ�ѧ����ʽ_ ��
��5�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ____ ����ѧ�����ô�ԭ������Ƴɰ���������ȼ�ϵ�أ���ͨ�˰����ĵ缫�� ��������������������ڼ��������£�ͨ�˰����ĵ缫�����ĵ缫��ӦʽΪ ��
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����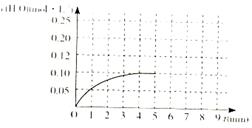
 NH2CO2NH4(s) ��H1="a" kJ��mol��1
NH2CO2NH4(s) ��H1="a" kJ��mol��1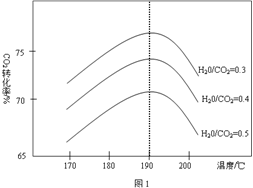

 CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��

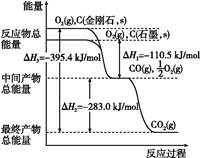
 TiCl4(l)��H="-804.2" kJ/mol
TiCl4(l)��H="-804.2" kJ/mol
 HOI(aq) ����H2
HOI(aq) ����H2