题目内容
4.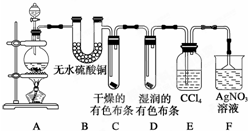 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)该同学用MnO2与浓盐酸反应制取氯气,加入试剂的前一步的实验操作是检验装置的气密性;用方程式表示制取氯气的反应原理MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)①装置B中现象是无水硫酸铜变蓝.
②证明Cl2无漂白性而Cl2和H2O反应产物有漂白性的实验现象为C中干燥的有色布条不褪色,D中湿润的有色布条褪色.
(3)为进一步确定使有色布条褪色的物质是Cl2和H2O反应产物中的哪一种,还应补充什么实验操作:(操作,现象,结论)可将一红色布条伸入稀盐酸溶液中,若红色布条不褪色,则证明使红色布条褪色的是HClO,而不是盐酸..
分析 (1)实验室制备气体,连接装置后,第一步操作应该检验装置的气密性;实验室用MnO2与浓盐酸反应制取氯气;
(2)①从A制取的氯气中含有水蒸气,白色的无水硫酸铜与水反应生成蓝色的五水硫酸铜用来检测水的存在;
②氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(3)氯气与水反应生成盐酸和次氯酸,只要验证盐酸不具有漂白性即可.
解答 解:(1)实验室制备气体,连接装置后,第一步操作应该检验装置的气密性;实验室用MnO2与浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:检验装置的气密性;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)①从A制取的氯气中含有水蒸气,白色的无水硫酸铜与水反应生成蓝色的五水硫酸铜,所以现象为:无水硫酸铜变蓝;
故答案为:无水硫酸铜变蓝;
②C中干燥的有色布条不褪色,D中湿润的有色布条褪色,即可证明氯气不具有漂白性,具有漂白性的是次氯酸;
故答案为:C中干燥的有色布条不褪色,D中湿润的有色布条褪色;
(3)氯气与水反应生成盐酸和次氯酸,使有色布条褪色的是次氯酸;如果盐酸具有漂白性,则:将一红色布条伸入稀盐酸溶液中,则红色布条褪色;
故答案为:可将一红色布条伸入稀盐酸溶液中,若红色布条不褪色,则证明使红色布条褪色的是HClO,而不是盐酸.
点评 本题考查了氯气的制取、性质及次氯酸的探究性实验的设计,明确氯气和次氯酸的性质是解题关键,注意分离物质方法选择的原则,题目难度不大.

练习册系列答案
相关题目
17.短周期金属元素甲~戊在元素周期表的相对位置如表所示.下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
1.草酸与高锰酸钾在酸性条件下反生反应离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验Ⅰ 和Ⅱ(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ.
(2)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
(2)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
9.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如图1:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
(1)从滤渣1中分离出Al2O3的部分流程如下所示,括号中表示加入过量的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
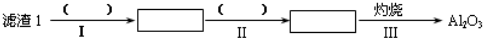
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
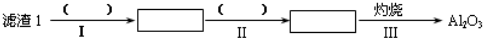
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
14.若要使2mol CH4完全和Cl2发生取代反应,且生成的四种氯代物的物质的量相同,则所需Cl2的物质的量为( )
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |

