题目内容
17.下列变化一定会引起平衡移动的是( )①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化
⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化.
| A. | ①②⑥⑦⑧ | B. | ②④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ③④⑦⑧ |
分析 影响平衡移动的因素只有温度、浓度和压强三方面因素,当改变影响平衡的一个条件,平衡向减弱这种改变的方向移动,据此分析.
解答 解:①反应速率的变化可能使用催化剂,平衡不移动,故①错误;
②浓度的变化,对于反应前后气体体积不变的反应可以改变体积,平衡不移动,故②错误;
③各组分百分含量的变化,说明平衡一定发生移动,故③正确;
④平均相对分子质量的变化,说明平衡一定发生移动,故④正确;
⑤颜色的变化,对于反应前后气体体积不变的反应可以改变体积,平衡不移动,故⑤错误;
⑥混合气体密度的变化,对于反应前后气体体积不变的反应可以改变体积,平衡不移动,故⑥错误;
⑦转化率的变化,说明平衡一定发生移动,故⑦正确;
⑧因为反应不是吸热就是放热,所以温度的变化,说明平衡一定发生移动,故⑧正确;
故选D.
点评 本题考查学生影响化学平衡移动的因素,注意每个因素的使用情况是解答的关键.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
7.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
8.下列说法中正确的是( )
| A. | 标准状况下,11.2L N2和17g NH3中所含有的N原子数相同 | |
| B. | 9g H2O和0.5mol O2中含的原子数相同 | |
| C. | 20℃时,相同体积的N2、O2一定含有相同的分子数 | |
| D. | 在常温常压下,20mL CH4与60mL O2所含的原子个数比为1:3 |
5.已知A(g)+C(g)=D(g);△H=-Q1kJ/mol,B(g)+C(g)=E(g),△H=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( )
| A. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{3}}$ | B. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{3}-{Q}_{2}}$ | C. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{2}}$ | D. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{1}-{Q}_{2}}$ |
12.下列说法正确的是( )
| A. | 同物质的量的N2和HCl的原子数相同,分子数也相同 | |
| B. | 0.05mol H2SO4含有氧原子数的精确值为1.024×1023 | |
| C. | 0.1mol氯的微粒数约为6.02×1023个 | |
| D. | 1mol NaClO含有阿伏加德罗常数个氯分子 |
8.W粒子的结构如图所示,下列关于它的说法不正确的是( )
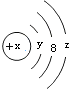

| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |

 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.