题目内容
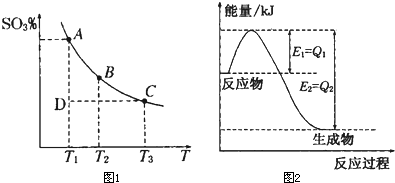
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:

①2SO2(g)+O2(g)?2SO3(g)的△H______0(选填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(选填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(选填“>”、“<”或“=”).
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①图2是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式:______、______.(△H的数值用含字母a、b的代数式表示,不必注明反应条件)
②氨气溶于水得到氨水.在25℃下,将xmol?L-1的氨水与ymol?L-1的盐酸等体积混合,所得溶液呈中性.则x______y,所得溶液中c(NH4+)______C(Cl-)(选填“>”、“<”或“=”);用含x和y的代数式表示出一水合氨的电离平衡常数______.
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L-1的NaCl溶液中逐滴加入适量的0.1mol?L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.
【答案】分析:(1)①根据温度对化学平衡的影响结合图象分析该反应是放热反应还是吸热反应;根据压强对反应体系的影响分析;
②根据T1的T2关系结合图象分析平衡的移动,根据反应物和生成物物质的量的改变引起化学平衡常数的改变判断K1、K2的关系;根据图象中曲线及曲线上、下方区域表示的含义分析,曲线表示平衡状态,曲线下方表示向正反应方向进行,曲线上方表示向逆反应方向进行;
(2)①根据热化学反应方程式的书写规则书写,书写时注意表明物质的状态,反应热=反应物吸收的能量-生成物放出的能量,注意反应热与反应方程式有关.
②由氯化铵的性质分析溶液的酸碱性,从而判断酸、碱浓度的相对大小;根据溶液中阴阳离子所带电荷相等分析c(NH4+)、C(Cl-)的相对大小;
(3)根据难溶电解质的溶解平衡常数判断氯离子和碘离子产生沉淀所需银离子的浓度,从而确定反应现象,并写出相应的离子方程式;
解答:解:(1)①该反应是一个气体体积减小的反应,升高温度,平衡向吸热反应方向移动,升高温度时,SO3(g)的含量降低,说明平衡向逆反应方向移动,所以正反应是放热反应,
△H<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,该反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动.
故答案为:<;向左;
②该反应是一个放热反应,升高温度,平衡向逆反应方向移动,所以生成物的浓度减小,反应物的浓度增大,平衡常数减小,所以K1>K2;D状态相对于A状态,三氧化硫的含量较小,要使该反应达到平衡状态,该反应必须向正反应方向移动,所以正反应速率大于逆反应速率.
故答案为:>;>;
(2)①氮气和氢气反应生成氨气,反应热=反应物吸收的能量-生成物放出的能量,所以该反应的热化学反应方程式为:N2(g)+3H2(g) 2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1;
故答案为:N2(g)+3H2(g)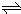 2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1;
②氯化铵是强酸弱碱盐,其水溶液呈酸性,若要使将xmol?L-1的氨水与ymol?L-1的盐酸等体积混合,所得溶液呈中性,应使氨水稍过量,所以x>y;该溶液中阴阳离子所带电荷相等,溶液呈中性,所以氢离子和氢氧根离子的浓度相等,故c(NH4+)=C(Cl-).
该溶液呈中性,所以C(H+)=C(OH-)=10-7mol?L-1;c(NH4+)=C(Cl-)=0.5ymol/L,再根据物料守恒知,c(NH4+)+C(NH3.H2O)=0.5xmol/L,所以平衡常数K=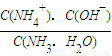 =
=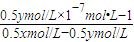 =
=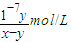 ,
,
故答案为:>;=;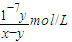 ;
;
(3)Ksp[AgCl]=1.0×10-1 mol2?L-2 ,所以生成氯化银沉淀所需的银离子的浓度为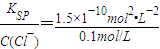 =1.5×10-9mol/L,
=1.5×10-9mol/L,
Ksp[AgI]=1.5×10-16mol2?L-2,所以生成碘化银 沉淀所需的银离子的浓度为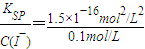 =1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
=1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
故答案为:白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
点评:本题考查了外界条件对化学平衡的影响、反应热的计算、难溶电解质的转化等知识点,难度不大,注意化学平衡常数只与温度有关,与其他物理量无关,会运用电荷守恒、物料守恒进行有关计算.
②根据T1的T2关系结合图象分析平衡的移动,根据反应物和生成物物质的量的改变引起化学平衡常数的改变判断K1、K2的关系;根据图象中曲线及曲线上、下方区域表示的含义分析,曲线表示平衡状态,曲线下方表示向正反应方向进行,曲线上方表示向逆反应方向进行;
(2)①根据热化学反应方程式的书写规则书写,书写时注意表明物质的状态,反应热=反应物吸收的能量-生成物放出的能量,注意反应热与反应方程式有关.
②由氯化铵的性质分析溶液的酸碱性,从而判断酸、碱浓度的相对大小;根据溶液中阴阳离子所带电荷相等分析c(NH4+)、C(Cl-)的相对大小;
(3)根据难溶电解质的溶解平衡常数判断氯离子和碘离子产生沉淀所需银离子的浓度,从而确定反应现象,并写出相应的离子方程式;
解答:解:(1)①该反应是一个气体体积减小的反应,升高温度,平衡向吸热反应方向移动,升高温度时,SO3(g)的含量降低,说明平衡向逆反应方向移动,所以正反应是放热反应,
△H<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,该反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动.
故答案为:<;向左;
②该反应是一个放热反应,升高温度,平衡向逆反应方向移动,所以生成物的浓度减小,反应物的浓度增大,平衡常数减小,所以K1>K2;D状态相对于A状态,三氧化硫的含量较小,要使该反应达到平衡状态,该反应必须向正反应方向移动,所以正反应速率大于逆反应速率.
故答案为:>;>;
(2)①氮气和氢气反应生成氨气,反应热=反应物吸收的能量-生成物放出的能量,所以该反应的热化学反应方程式为:N2(g)+3H2(g)
 2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1; 故答案为:N2(g)+3H2(g)
 2NH3(g);△H=2(a-b)kJ?mol-1;
2NH3(g);△H=2(a-b)kJ?mol-1;②氯化铵是强酸弱碱盐,其水溶液呈酸性,若要使将xmol?L-1的氨水与ymol?L-1的盐酸等体积混合,所得溶液呈中性,应使氨水稍过量,所以x>y;该溶液中阴阳离子所带电荷相等,溶液呈中性,所以氢离子和氢氧根离子的浓度相等,故c(NH4+)=C(Cl-).
该溶液呈中性,所以C(H+)=C(OH-)=10-7mol?L-1;c(NH4+)=C(Cl-)=0.5ymol/L,再根据物料守恒知,c(NH4+)+C(NH3.H2O)=0.5xmol/L,所以平衡常数K=
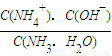 =
=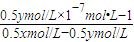 =
=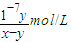 ,
,故答案为:>;=;
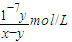 ;
;(3)Ksp[AgCl]=1.0×10-1 mol2?L-2 ,所以生成氯化银沉淀所需的银离子的浓度为
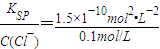 =1.5×10-9mol/L,
=1.5×10-9mol/L,Ksp[AgI]=1.5×10-16mol2?L-2,所以生成碘化银 沉淀所需的银离子的浓度为
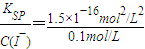 =1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
=1.5×10-15mol/L,所以氯化银会转化为碘化银,看到的现象为:白色沉淀转化为黄色沉淀,方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).故答案为:白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
点评:本题考查了外界条件对化学平衡的影响、反应热的计算、难溶电解质的转化等知识点,难度不大,注意化学平衡常数只与温度有关,与其他物理量无关,会运用电荷守恒、物料守恒进行有关计算.

练习册系列答案
相关题目

 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.