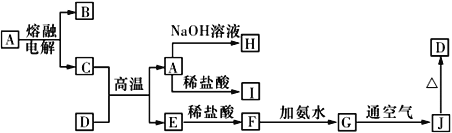
جâؤ؟ؤعبف
،¾جâؤ؟،؟رذ¾؟CO2µؤہûسأ¶ش´ظ½ّµحج¼ةç»لµؤ¹¹½¨¾كسذضطزھµؤزâزه،£
£¨1£©شعز»¶¨جُ¼دآ½«CO2؛حH2×ھ»¯خھ¼×´¼صôئّ؛حث®صôئّµؤدà¹ط·´س¦سذ£؛
CO2(g)£«H2(g) ![]() CO(g)£«H2O(g) ،÷H1£½£«41KJ/mol
CO(g)£«H2O(g) ،÷H1£½£«41KJ/mol
CO(g)£«2 H2(g)![]() CH3OH(g) ،÷H2£½£90KJ/mol
CH3OH(g) ،÷H2£½£90KJ/mol
شٍسة¼×´¼صôئّ؛حث®صôئّ×ھ»¯خھCO2؛حH2µؤبب»¯ر§·½³جت½خھ___________________،£
£¨2£©شعز»¶¨خآ¶بدآ£¬دٍ2L¹ج¶¨بف»µؤأـ±صبفئ÷ضذح¨بë2molCO2،¢3molH2£¬·¢ةْ·´س¦
CO2(g)£«3H2(g)![]() CH3OH(g)£«H2O(g) ،÷H3<0£®
CH3OH(g)£«H2O(g) ،÷H3<0£®
²âµأCO2(g)؛حCH3OH(g)µؤإ¨¶بثوت±¼ن±ن»¯بçح¼ثùت¾،£
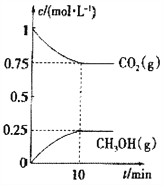
¢ظؤـثµأ÷¸أ·´س¦زر´ïئ½؛â×´ج¬µؤتا______________،£
A£®µ¥خ»ت±¼نؤعسذ3nmolH،ھH¼ü¶دءر£¬ح¬ت±سضسذ2nmolO،ھH¼ü¶دءر
B£®»ى؛دئّجهµؤئ½¾ùدà¶ش·ض×سضتء؟²»ثوت±¼ن±ن»¯
C£®»ى؛دئّجهµؤأـ¶ب²»ثوت±¼ن±ن»¯
D£®جهدµضذn(CO2)/n(H2)£½1،أ1£¬از±£³ض²»±ن
¢عدآءذ´ëت©ؤـت¹n(CH3OH)/n(CO2)شِ´َµؤتا__________،£
A£®ة¸كخآ¶بB£®؛مخآ؛مبفدآ£¬شظ³نبë2molCO2،¢3molH2
C£®ت¹سأ¸كذ§´ك»¯¼ء D£®؛مخآ؛مبف³نبëHe(g)ت¹جهدµر¹ا؟شِ´َ
¢غزرضھ¸أخآ¶بدآ´ث·´س¦µؤئ½؛â³£تK=0.198£¬بôت¹Kµؤضµ±نخھ1£¬س¦²ةب،µؤ´ëت©تا___________،£
A£®ة¸كخآ¶ب B£®½µµحخآ¶ب C£®شِ´َر¹ا؟ D£®؛مر¹¼سبëز»¶¨ء؟H2
£¨3£©²¶×½CO2؟ةزشہûسأNa2CO3بـز؛،£سأ100mL0.1 mol/LNa2CO3بـز؛حêب«²¶×½0.44gCO2ئّجه£¨بـز؛جه»²»±ن£©£¬ثùµأبـز؛ضذc(HCO3£)£«c(CO32£)£«c(H2CO3)£½__________mol/L
£¨4£©سأCO2؛حجىب»ئّ؟ةزشضئ±¸CO؛حH2£¬CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)،£أـ±صبفئ÷ضذإ¨¶ب¾ùخھ0.1mol/LµؤCH4سëCO2£¬شعز»¶¨جُ¼دآ·´س¦£¬²âµأCH4 µؤئ½؛â×ھ»¯آتسëخآ¶ب¼°ر¹ا؟µؤ¹طدµبçح¼ثùت¾£¬شٍر¹ا؟P1 ____P2£¨جî،°>،±»ٍ،°<،±£©،£بôP2=3MPa£¬شٍT،مCت±¸أ·´س¦µؤئ½؛â³£تKp =_____MPa2£¨سأئ½؛â·ضر¹´ْجوئ½؛âإ¨¶ب¼ئثم£¬·ضر¹=×ـر¹،ءخïضتµؤء؟·ضت£©،£
2CO(g)+2H2(g)،£أـ±صبفئ÷ضذإ¨¶ب¾ùخھ0.1mol/LµؤCH4سëCO2£¬شعز»¶¨جُ¼دآ·´س¦£¬²âµأCH4 µؤئ½؛â×ھ»¯آتسëخآ¶ب¼°ر¹ا؟µؤ¹طدµبçح¼ثùت¾£¬شٍر¹ا؟P1 ____P2£¨جî،°>،±»ٍ،°<،±£©،£بôP2=3MPa£¬شٍT،مCت±¸أ·´س¦µؤئ½؛â³£تKp =_____MPa2£¨سأئ½؛â·ضر¹´ْجوئ½؛âإ¨¶ب¼ئثم£¬·ضر¹=×ـر¹،ءخïضتµؤء؟·ضت£©،£

،¾´ً°¸،؟ CH3OH£¨g£©£«H2O£¨g£©![]() CO2£¨g£©£«3H2£¨g£©،÷H£½+49 kJ/mol B D B B 0.2 < 4
CO2£¨g£©£«3H2£¨g£©،÷H£½+49 kJ/mol B D B B 0.2 < 4
،¾½âخِ،؟(1)سةزرضھ·´س¦¢ظCO2(g)£«H2(g) ![]() CO(g)£«H2O(g) ،÷H1£½£«41KJ/mol£¬·´س¦¢عµؤؤو·´س¦خھ·´س¦¢غCH3OH(g)
CO(g)£«H2O(g) ،÷H1£½£«41KJ/mol£¬·´س¦¢عµؤؤو·´س¦خھ·´س¦¢غCH3OH(g) ![]() CO(g)£«2 H2(g) ،÷H3£½+90KJ/mol£¬¸ù¾ف¸اث¹¶¨آة·´س¦¢غ-¢ظ¼´µأCH3OH(g)+ H2O(g)
CO(g)£«2 H2(g) ،÷H3£½+90KJ/mol£¬¸ù¾ف¸اث¹¶¨آة·´س¦¢غ-¢ظ¼´µأCH3OH(g)+ H2O(g) ![]() CO2(g)£«3H2(g) ،÷H£½+49 kJ/mol£»
CO2(g)£«3H2(g) ،÷H£½+49 kJ/mol£»
(2) ¢ظسة»¯ر§ئ½؛âCO2(g)£«3H2(g)![]() CH3OH(g)£«H2O(g)؟ةضھ£¬A،¢µ¥خ»ت±¼نؤعسذ3n mol H،ھH¼ü¶دءر£¬¼´3n mol H2(g)²خ¼سءث·´س¦£¬±يت¾µؤتاصدٍثظآت£»O،ھH¼ü¶دءر±يت¾ؤودٍثظآت£¬µ«ةْ³ةخïضذ1mol CH3OH(g)ضذ؛¬سذ1molO،ھH¼ü£¬1mol H2O(g)ضذ؛¬سذ2 molO،ھH¼ü£¬ثùزشس¦¸أتاسذ3n molO،ھH¼ü¶دءر£¬¹تA²»صب·£»B،¢»ى؛دئّجهµؤ×ـضتء؟²»±ن£¬×ـخïضتµؤء؟شع¸ؤ±ن£¬سةM=m/n؟ةضھ£¬µ±ئ½¾ùدà¶ش·ض×سضتء؟²»ثوت±¼ن±ن»¯ت±£¬·´س¦زر´ïئ½؛â×´ج¬£¬¹تBصب·£»C،¢»ى؛دئّجهµؤ×ـضتء؟²»±ن£¬بفئ÷جه»²»±ن£¬سة¦ر=m/V؟ةضھ£¬أـ¶بت¼ضص²»±ن£¬زٍ´ثµ±»ى؛دئّجهµؤأـ¶ب²»ثوت±¼ن±ن»¯ت±£¬²»ؤـثµأ÷·´س¦زر´ïئ½؛â×´ج¬£¬¹تC´يخَ£»D،¢سةسع·´س¦خïئًت¼ء؟n(CO2)؛حn(H2)سëدµت²»³ة±بہ£¬ثùزشµ±n(CO2)/n(H2)£½1،أ1از±£³ض²»±نت±£¬ثµأ÷·´س¦زر´ïئ½؛â×´ج¬£¬¹تDصب·،£¹تصب·´ً°¸خھBD،£
CH3OH(g)£«H2O(g)؟ةضھ£¬A،¢µ¥خ»ت±¼نؤعسذ3n mol H،ھH¼ü¶دءر£¬¼´3n mol H2(g)²خ¼سءث·´س¦£¬±يت¾µؤتاصدٍثظآت£»O،ھH¼ü¶دءر±يت¾ؤودٍثظآت£¬µ«ةْ³ةخïضذ1mol CH3OH(g)ضذ؛¬سذ1molO،ھH¼ü£¬1mol H2O(g)ضذ؛¬سذ2 molO،ھH¼ü£¬ثùزشس¦¸أتاسذ3n molO،ھH¼ü¶دءر£¬¹تA²»صب·£»B،¢»ى؛دئّجهµؤ×ـضتء؟²»±ن£¬×ـخïضتµؤء؟شع¸ؤ±ن£¬سةM=m/n؟ةضھ£¬µ±ئ½¾ùدà¶ش·ض×سضتء؟²»ثوت±¼ن±ن»¯ت±£¬·´س¦زر´ïئ½؛â×´ج¬£¬¹تBصب·£»C،¢»ى؛دئّجهµؤ×ـضتء؟²»±ن£¬بفئ÷جه»²»±ن£¬سة¦ر=m/V؟ةضھ£¬أـ¶بت¼ضص²»±ن£¬زٍ´ثµ±»ى؛دئّجهµؤأـ¶ب²»ثوت±¼ن±ن»¯ت±£¬²»ؤـثµأ÷·´س¦زر´ïئ½؛â×´ج¬£¬¹تC´يخَ£»D،¢سةسع·´س¦خïئًت¼ء؟n(CO2)؛حn(H2)سëدµت²»³ة±بہ£¬ثùزشµ±n(CO2)/n(H2)£½1،أ1از±£³ض²»±نت±£¬ثµأ÷·´س¦زر´ïئ½؛â×´ج¬£¬¹تDصب·،£¹تصب·´ً°¸خھBD،£
¢عسةسعCO2(g)تا·´س¦خCH3OH(g)تاةْ³ةخثùزش¸أئ½؛âدٍصدٍزئ¶¯²إؤـت¹n(CH3OH)/n(CO2)شِ´َ£¬سضضھ¸أ·´س¦تائّجهجه»ثُذ،µؤ·إبب·´س¦،£شٍA،¢ة¸كخآ¶ب£¬¸أئ½؛âدٍؤودٍزئ¶¯£¬¹تA´يخَ£»B،¢؛مخآ؛مبفدآ£¬شظ³نبë2mol CO2،¢3mol H2£¬د൱سع¼سر¹£¬شٍئ½؛âصدٍزئ¶¯£¬¹تBصب·£»C،¢ت¹سأ´ك»¯¼ءض»تا¼س؟ىءث·´س¦ثظآت£¬µ«ئ½؛â²»زئ¶¯£¬¹تC´يخَ£»D،¢؛مخآ؛مبف³نبëHe(g)£¬¾،¹ـؤـت¹×ـر¹ا؟شِ´َ£¬µ«·´س¦جهدµµؤ·ضر¹²»±ن£¬¼´·´س¦»ى؛دخïµؤإ¨¶ب¶¼²»±ن£¬ثùزشئ½؛â²»زئ¶¯£¬¹تD´يخَ£»زٍ´ثصب·´ً°¸خھB،£
¢غزرضھ¸أ·´س¦تا·إبب·´س¦£¬ازئ½؛â³£تKض»ثوخآ¶بµؤ±ن»¯¶ّ¸ؤ±ن£¬زھت¹ئ½؛â³£تKضµشِ´َ£¬شٍئ½؛âصدٍزئ¶¯£¬ثùزش²ةب،µؤ´ëت©¾حتا½µµحخآ¶ب£¬¼´صب·´ً°¸خھB،£
(3)زرضھNa2CO3سëCO2·´س¦µؤ·½³جت½خھNa2CO3£«CO2£«H2O![]() 2NaHCO3£¬n(Na2CO3)= 0.10 L،ء0.1 mol/L=0.01 mol£¬n(CO2)=
2NaHCO3£¬n(Na2CO3)= 0.10 L،ء0.1 mol/L=0.01 mol£¬n(CO2)=![]() £¬زٍ´ث¶صكا،؛أحêب«·´س¦ةْ³ة0.02molµؤNaHCO3£¬سةسعHCO3£¼بؤـث®½âةْ³ةH2CO3£¬سضؤـµçہëةْ³ةCO32££¬¸ù¾فخïءدتط؛م؟ةµأ£¬بـز؛ضذc(HCO3£)£«c(CO32£)£«c(H2CO3)£½0.02mol/0.1L=0.2 mol/L،£
£¬زٍ´ث¶صكا،؛أحêب«·´س¦ةْ³ة0.02molµؤNaHCO3£¬سةسعHCO3£¼بؤـث®½âةْ³ةH2CO3£¬سضؤـµçہëةْ³ةCO32££¬¸ù¾فخïءدتط؛م؟ةµأ£¬بـز؛ضذc(HCO3£)£«c(CO32£)£«c(H2CO3)£½0.02mol/0.1L=0.2 mol/L،£
(4)سةح¼دَ؟ةضھCH4 µؤئ½؛â×ھ»¯آتثوخآ¶بة¸ك¶ّشِ´َ£¬شعر¹ا؟خھP1ت±CH4 µؤئ½؛â×ھ»¯آت±ن»¯آ£¬¶ّر¹ا؟P2ت±£¬CH4 µؤئ½؛â×ھ»¯آت±ن»¯؟ى£¬ازشعدàح¬خآ¶بدآ£¬سةP2×ھ»¯P1ت±£¬CH4 µؤئ½؛â×ھ»¯آتشِ´َ£¬ثµأ÷ئ½؛âصدٍزئ¶¯£¬صâتاز»¸ِئّجهجه»شِ´َµؤ·´س¦£¬شٍ¼ُذ،ر¹ا؟£¬ئ½؛âصدٍزئ¶¯£¬ثùزشP1< P2£»ةèبفئ÷µؤجه»خھ1L£¬سةح¼دَ؟ةضھ£¬ئ½؛âت±n(CH4)=n(CO2) =0.1mol/L،ء1L،ء(1-50%)=0.05 mol£¬n(H2)=n(CO)=0.1mol L،ء1L،ء50%،ء2=0.1 mol£¬ثùزشp(CH4)= p(CO2)=P2،ء![]() = 0.5 MPa£¬p(H2)= p(CO)=P2،ء
= 0.5 MPa£¬p(H2)= p(CO)=P2،ء![]() = 1.0 MPa£¬ثùزشKp=
= 1.0 MPa£¬ثùزشKp=![]() =
=![]() = 4 (Mpa)2،£
= 4 (Mpa)2،£

 شؤ¶ء؟ى³µدµءذ´ً°¸
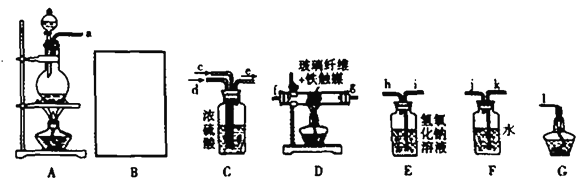
شؤ¶ء؟ى³µدµءذ´ً°¸،¾جâؤ؟،؟ؤةأ×¼¶Cu2Oسةسع¾كسذسإء¼µؤ´ك»¯ذشؤـ¶ّتـµ½¹ط×¢£¬دآ±يخھضئب،Cu2Oµؤبضض·½·¨£؛
ؤةأ×¼¶Cu2Oسةسع¾كسذسإء¼µؤ´ك»¯ذشؤـ¶ّتـµ½¹ط×¢£¬دآ±يخھضئب،Cu2Oµؤبضض·½·¨£؛
·½·¨a | سأج؟·غشع¸كخآجُ¼دآ»¹شCuO |
·½·¨b | µç½â·¨£¬·´س¦خھ2Cu + H2O |
·½·¨c | سأëآ£¨N2H4£©»¹شذآضئCu(OH)2 |
£¨1£©زرضھ£؛2Cu(s)£«![]() O2(g)=Cu2O(s)،÷H =-169kJ،¤mol-1
O2(g)=Cu2O(s)،÷H =-169kJ،¤mol-1
C(s)£«![]() O2(g)=CO(g)،÷H =-110.5kJ،¤mol-1
O2(g)=CO(g)،÷H =-110.5kJ،¤mol-1
Cu(s)£«![]() O2(g)=CuO(s)،÷H =-157kJ،¤mol-1
O2(g)=CuO(s)،÷H =-157kJ،¤mol-1
شٍ·½·¨a·¢ةْ·´س¦µؤبب»¯ر§·½³جت½تا_____________________________________،£
£¨2£©·½·¨b²ةسأہë×س½»»»ؤ¤؟طضئµç½âز؛ضذOH-µؤإ¨¶ب¶ّضئ±¸ؤةأ×Cu2O£¬×°ضأبçح¼ثùت¾£¬¸أہë×س½»»»ؤ¤خھ______ہë×س½»»»ؤ¤(جî،°زُ،±»ٍ،°رô،±),¸أµç³طµؤرô¼«·´س¦ت½خھ______________________________________،£

£¨3£©·½·¨cخھ¼سببجُ¼دآسأز؛ج¬ëآ£¨N2H4£©»¹شذآضئCu(OH)2ہ´ضئ±¸ؤةأ×¼¶Cu2O£¬ح¬ت±·إ³ِN2£¬¸أضئ·¨µؤ»¯ر§·½³جت½خھ________________________________________،£
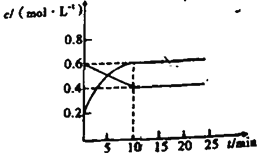
£¨4£©شعبف»خھ1Lµؤ؛مبفأـ±صبفئ÷ضذ£¬سأزشةد·½·¨ضئµأµؤبضضؤةأ×¼¶Cu2O·ض±ً½ّذذ´ك»¯·ض½âث®µؤتµرé£؛2H2O(g) ![]() 2H2(g)+O2(g)£¬¦¤H>0،£ث®صôئّµؤإ¨¶بcثوت±¼نtµؤ±ن»¯بçدآ±يثùت¾،£
2H2(g)+O2(g)£¬¦¤H>0،£ث®صôئّµؤإ¨¶بcثوت±¼نtµؤ±ن»¯بçدآ±يثùت¾،£

¢ظ¶ش±بتµرéµؤخآ¶ب£؛T2_________T1£¨جî،°£¾،±،¢،°£¼،±»ٍ،°=،±£©
¢ع´ك»¯¼ء´ك»¯ذ§آت£؛تµرé¢ظ________تµرé¢ع£¨جî،°£¾،±»ٍ،°£¼،±£©
¢غشعتµرé¢غ´ïµ½ئ½؛â×´ج¬؛َ£¬دٍ¸أبفئ÷ضذح¨بëث®صôئّسëاâئّ¸÷0.1mol£¬شٍ·´س¦شظ´خ´ïµ½ئ½؛âت±£¬بفئ÷ضذرُئّµؤإ¨¶بخھ ____________________،£