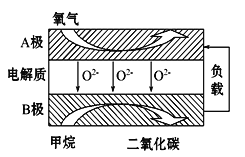
题目内容
【题目】氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、干燥,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
【答案】
(1)溶液中不再产生气泡(或只有极少数气泡)
(2)3;Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
(3)FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O
(4)过滤;洗涤
(5)稀硫酸和酸性KMnO4溶液;90.9%
【解析】
试题分析:(1)步骤2中稀硫酸与氧化铁反应,过量的硫酸与铁反应放出氢气,当溶液中不再产生气泡(或只有极少数气泡)时,说明表面的铁锈已完全溶解,故答案为:溶液中不再产生气泡(或只有极少数气泡);
(2)W在足量的空气中高温煅烧,生成有磁性的固体X,X为四氧化三铁,同时生成二氧化碳,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁。
①煅烧时1 mol W生成四氧化三铁和二氧化碳,将Fe3C中元素的化合价均看成0价,消耗O2的物质的量为![]() =3mol,故答案为:3;
=3mol,故答案为:3;
②四氧化三铁溶于稀硫酸的离子方程式为Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O,故答案为:Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
(3)步骤3 中FeSO4与NH4HCO3反应生成FeCO3,反应的化学方程式为FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O,故答案为:FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O;
(4)根据实验步骤,可知,步骤4是分离得到FeCO3固体,因此需要过滤;洗涤,故答案为:过滤;洗涤;
(5)①FeO用酸溶解生成亚铁离子,亚铁离子具有还原性,可以使酸性高锰酸钾溶液褪色,故答案为:稀硫酸和酸性KMnO4溶液;
②假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,那么满足:160x+72y=79200;(2x+y)×116=116000,解得x=450mol,所以产物中Fe2O3的质量160g/mol×450mol=72000g=72kg,该产品的纯度为![]() ×100%=90.9%,故答案为:90.9%。
×100%=90.9%,故答案为:90.9%。

 阅读快车系列答案
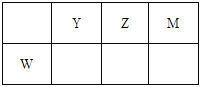
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | Y | Z | |
X | 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。