��Ŀ����
����Ŀ���������������ǵĽ���ϢϢ��أ�Ŀǰ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2��CO������3���е���Ⱦ�
��1��һ���¶��£���̶����Ϊ2L���ܱ������г���SO2��NO2��1mol��������ӦSO2��g��+NO2��g��SO3��g��+NO��g�������������Ӧ5minĩ����ƽ�⣬��ʱ������NO��NO2�������Ϊ3��1�������ʱ����SO2�ķ�Ӧ���ʦԣ�SO2��= �� �˷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K= ��
��2���״�������Ϊ��Ҫ���л�ȼ�ϣ�ͨ������CO��H2�ϳɼ״����䷴Ӧ�Ļ�ѧ����ʽΪCO��g��+2H2��g��CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10mol CO��20mol H2���ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��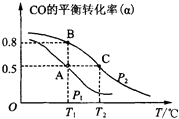
�������ϳɼ״��ķ�ӦΪ��Ӧ������ȡ������ȡ�����
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ �� A��B�����Ӧ��ѹǿ��С��ϵ��PAPB������ڡ�����С�ڡ����ڡ�����
�������ﵽƽ��״̬Aʱ���ɵļ״����ڹ��ɼ״�һ����ȼ�ϵ�أ��������ҺΪKOHŨ��Һ����õ�ع���ʱ�����ĵ缫��ӦʽΪ �� ������ͨ�����·�ĵ������Ϊ mol��
���𰸡�
��1��0.075mol/��L?min����9
��2��KA=KB��KC��KA=KB��KC��С�ڣ�O2+2H2O+4e��=4OH����30
���������⣨1����μӷ�Ӧ��SO2Ϊnmol
SO2��g�� | + | NO2��g�� | = | SO3��g�� | + | NO��g�� | |
��Ӧǰ��mol�� | 1 | 1 | 0 | 0 | |||
��Ӧ�ˣ�mol�� | n | n | n | n | |||
5minĩ��mol�� | 1��n | 1��n | n | n |
![]() =
= ![]() ����ã�n=
����ã�n= ![]() =0.75
=0.75
�ԣ�SO2��= ![]() =0.075mol/��Lmin��
=0.075mol/��Lmin��
���������2L��������Ե�Ũ�ȴ������K
K= ![]() =9
=9
���Դ��ǣ�0.075mol/��Lmin����9��
��2.���ٴ�ͼ�Ͽɼ�����P2ʱ�����¶ȵ�����CO��ת����Խ��Խ�ͣ��ɼ�������ʱƽ���������ƶ�������������ԭ��������Ӧ���ȣ�
���Դ��ǣ����ȣ�
�ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�÷�Ӧ���ȣ��¶�Խ��ƽ�������ƶ���Kֵ��С������ѹǿ��ƽ�������ƶ���CO��ת��������֪PA С��PB ��
���Դ��ǣ�KA=KB��KC��С�ڣ�
��ȼ�ϵ�ص���������������Ӧ���ڼ�����������ˮ����������������
O2+2H2O+4e��=4OH��
A��CO��ƽ��ת����50%���μӷ�Ӧ��COΪ��10mol��50%=5mol
��CO��g��+2H2��g��=CH3OH��g������������CH3OHҲΪ5mol��CH3OHȼ�����ɶ�����̼��ˮ��ֻ��C�ļ�̬�ө�2��Ϊ+4��H��O��̬û�䣬����1molCH3OHȼ��ת��6mol���ӣ���5molCH3OH��Ӧת�Ƶ���Ϊ��5��6=30��
���Դ��ǣ�O2+2H2O+4e��=4 OH����30��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


