题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
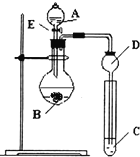
(1)图中D装置名称是______.
(2)N、C、Si的非金属性由强到弱的顺序是:______;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为______;试剂C为______(填序号).
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3)①乙同学设计的实验所用到试剂A为______;试剂B为______;试剂C为______.(写名称)
②写出C中发生反应的化学方程式______.
【答案】长颈漏斗 N、C、Si ① ④ 双氧水 二氧化锰 氢硫酸或硫化钠溶液 2H2S+O2=2S↓+2H2O
【解析】
(1)根据装置图分析;
(2)根据同周期和同主族元素非金属性的变化规律分析;通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸依此选择试剂;
(3)通过比较单质的氧化性来判断非金属性。
(1)由装置图可知,A为加液装置,A为分液漏斗,故答案为:长颈漏斗;
(2)同周期从左到右非金属性增强,则C<N,同主族元素从上到下非金属性:C>Si,所以非金属性由强到弱的顺序是:N>C>Si;通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,故答案为:N、C、Si; ①;④;
(3)①完成了O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单质,故答案为:双氧水; 二氧化锰; 氢硫酸或硫化钠溶液;
②C中发生反应的方程式为:2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O。