题目内容
下列原理和定律中,可用于判断化学平衡移动方向的是
| A.盖斯定律 | B.阿伏加德罗定律 | C.勒夏特列原理 | D.质量守恒定律 |
C
解析试题分析:盖斯定律是用于判断反应热的定律,阿伏加德罗定律是用于判断个反应条件之间关系的定律,勒夏特列原理用于判断化学平衡移动方向,质量守恒定律用于判断质量之间的关系。
考点:基本定律的应用范围

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
在某温度下,H2和I2各0.10mol的气态混合物充入10L的密闭容器中,发生反应:H2(g)+I2(g)  2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为( )
2HI(g),充分反应后达到平衡,测得c(H2)=0.008 mol?L-1,则该反应的平衡常数为( )
| A.40 | B.62.5 | C.0.25 | D.4 |
已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
| A.容器内压强P:P甲=P丙 > 2P乙 |
| B.SO3的质量m:m甲=m丙 > 2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙 |
氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
| A.5.4×10—5 | B.4.5×10—4 | C.0.015 | D.无法计算 |
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,下列研究目的和示意图相符的是
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
| | A | B | C | D |
| 研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
| 示意图 |  | 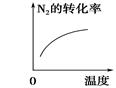 | 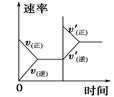 |  |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是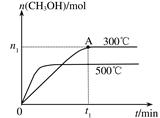
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t 1min内 CH3OH的平均生成速率为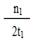 mol·L-1 min-1 mol·L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时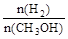 减小 减小 |
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
| A.使用催化剂并不能改变反应速率 | B.使用催化剂可以加快反应速率 |
| C.降低压强能加快反应速率 | D.降温可以加快反应速率 |
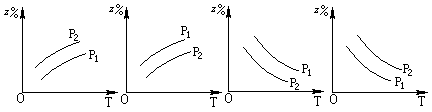
 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为