题目内容
4.电解熔融的氧化铝制取金属铝,若有0.2mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少摩尔?分析 根据电子转移守恒计算生成Al的物质的量,根据m=nM计算Al的质量,根据Al原子守恒计算氧化铝的物质的量.
解答 解:电解熔融的氧化铝制取金属铝,若有0.2mol电子发生转移,根据电子转移守恒,生成Al的物质的量为$\frac{0.2mol}{3}$=$\frac{1}{15}$mol,则生成Al的质量为$\frac{1}{15}$mol×27g/mol=1.8g,
根据Al原子守恒,氧化铝的物质的量为$\frac{1}{15}$mol×$\frac{1}{2}$=$\frac{1}{30}$mol,
答:理论上能得到金属铝1.8g,需氧化铝物质的量为$\frac{1}{30}$mol.
点评 本题考查化学方程式计算,注意利用守恒法计算解答,避免方程式的繁琐,比较基础.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
14.下列各组中,前者为附着在容器内壁的物质,后者为选用的洗涤剂.其中搭配不合适的是( )
| A. | 油脂、热的纯碱溶液 | B. | 硫黄、CS2 | ||
| C. | 水垢、食醋 | D. | 石蜡、蒸馏水 |
15.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 1molNa2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 1molCO2和NO2的混合物中含的氧原子数为4NA | |
| C. | 标准状况下,NA个CCl4分子所占的体积约为22.4L | |
| D. | 54g H2O中含有3NA个水分子 |
16.在10mL试管中集瞒了N02和N2的混合气体,把试管倒置在水槽中,水面上升,最后剩余6mL气体,由此可以说明( )
| A. | 原试管有4mL NO2 | B. | 6mL气体全部是N2 | ||
| C. | 原试管有6mL NO2 | D. | 剩余6mL气体是NO和N2的混合气体 |
8.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述不正确的是( )
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 蛋白质只含有C、H、O三种元素 | |
| C. | 油脂在碱性条件下水解可制肥皂 | |
| D. | 葡萄糖与新制氢氧化铜悬浊液共沸有砖红色沉淀产生 |

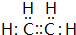 ,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O
,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O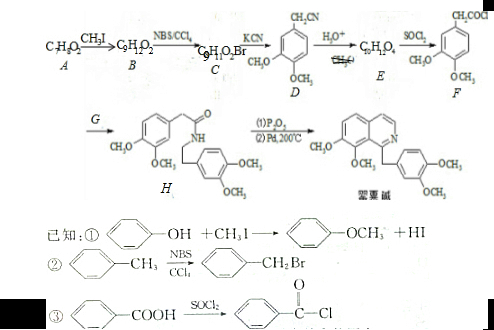
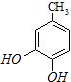 ;C分子中的官能团有醚键和溴原子.(填名称)
;C分子中的官能团有醚键和溴原子.(填名称)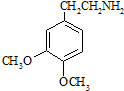 .
.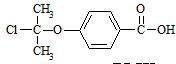 .
.