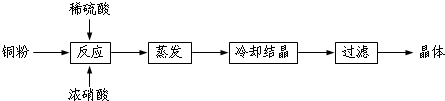
题目内容
17.把生铁冶炼成钢,目的是( )| A. | 改善性能,增大用途 | |
| B. | 除去硫、磷和过多的碳,调整合金元素的含量 | |
| C. | 副产磷肥、水泥等 | |
| D. | 用红棕色炉气制取水煤气 |
分析 生铁和钢都是铁的合金,其主要区别是含碳量不同,生铁中含碳量为2%-4.3%,钢中含碳量为0.03%-2%,炼钢是用氧气将生铁中多余的碳氧化从而降低含碳量.
解答 解:生铁与钢的主要区别是二者的含碳量不同,炼钢是用氧气将生铁中多余的碳氧化而除去,从而降低含碳量,达到改善性能、增大用途的作用,故A正确,
故选A.
点评 本题考查生铁与钢的相关知识,题目难度不大,明确炼钢的原理及目的为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
8.硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:
如图是模拟工业制备硫酸亚铁铵晶体的实验装置.
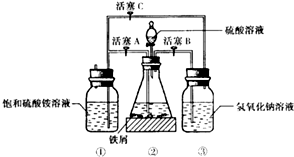
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABCD(填序号).
A.Fe+2H+═Fe2++H2↑
B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓
D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1•L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.
滴定时,将KMnO4溶液装在酸式(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |

回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABCD(填序号).
A.Fe+2H+═Fe2++H2↑
B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓
D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1•L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.
滴定时,将KMnO4溶液装在酸式(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
2.将一溴丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果没有看到浅黄色沉淀生成,其主要原因是( )
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
9.X、Y、Z均为短周期元素,X、Y同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
6.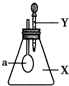 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )| X | Y | |
| A | NH3 | H2O |
| B | SO2 | NaOH溶液 |
| C | CO2 | 6mol•L-1 H2SO4溶液 |
| D | HCl | 6mol•L-1 Na2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
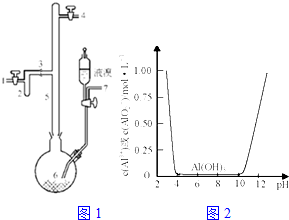 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.