题目内容
能证明碳酸比硅酸酸性强的实验事实是
| A.H2CO3比H2SiO3受热易分解 |
B.高温下能发生反应Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑ |
| C.CO2能溶于水生成碳酸,而SiO2却不溶于水 |
| D.CO2通入Na2SiO3溶液中有胶状沉淀生成 |
D
解析试题分析:A、稳定性由化合物内部的化学键强弱决定,A不正确;B、Na2CO3+SiO2 Na2SiO3+CO2↑的反应原理是同沸点制低沸点的物质,不是在水溶液中进行的反应,不能用它来得出硅酸的酸性强于碳酸的结论,B不正确;C、SiO2是原子晶体,原子间形成空间网状结构,因此难溶于水,与酸性无关,C不正确;D、CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3,酸性较强的碳酸制得酸性较弱的硅酸,D正确。选D。
Na2SiO3+CO2↑的反应原理是同沸点制低沸点的物质,不是在水溶液中进行的反应,不能用它来得出硅酸的酸性强于碳酸的结论,B不正确;C、SiO2是原子晶体,原子间形成空间网状结构,因此难溶于水,与酸性无关,C不正确;D、CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3,酸性较强的碳酸制得酸性较弱的硅酸,D正确。选D。
考点 :元素周期律、元素及其化合物的性质

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为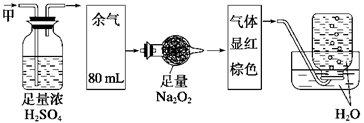
| A.Na2O2在此过程中作氧化剂 | B.甲气体的组成为NH3、NO、CO2 |
| C.甲气体的组成为NH3、NO2、CO2 | D.甲气体中NH3的体积分数为20% |
下列关于SO2性质的分析,肯定错误的是
| A.通入Ca(ClO)2溶液中,有HClO生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KICl2溶液中,有I-生成 |
亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见图。下列说法不正确的是( )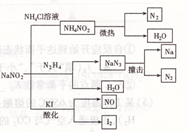
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2 H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1molN2转移6mole- |
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是…( )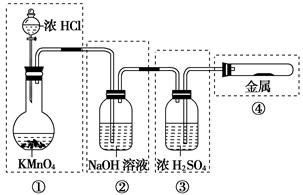
| A.①和②处 | B.②处 | C.②和③处 | D.②③④处 |
下列反应中HNO3既表现出酸性又表现出强氧化性的是( )
| A.稀硝酸与CuO反应 | B.稀硝酸与NaOH 溶液反应 |
| C.浓硝酸与灼热的碳反应 | D.浓硝酸与铜反应 |


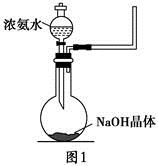

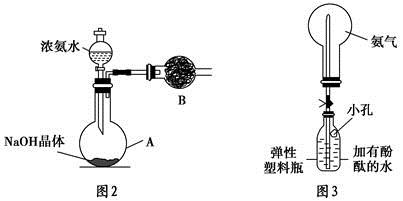
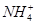 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动