题目内容
如下图为黑色固体化合物A及其产物的一系列反应的框图,每一个方框内表示一种反应物或生成物(反应条件和水已略去),其中A、C为反应物,C、F常温下为气体,

(1)写出B和C的化学式:B______________,C______________。
(2)写出反应③的方程式_____________________。
(3)写出把F通入到E物质的溶液中所发生反应的离子方程式:_____________________。
(1)FeSO4 H2S
(2)2H2S+3O2![]() 2SO2+2H2O
2SO2+2H2O
(3)2Fe3++SO2+2H2O====2Fe2++![]() +4H+
+4H+
解析:
黑色物质A加入G后反应生成气体C,说明G为酸,B与Cl2反应,所以B具有一定的还原性。C与O2反应生成气体F且C与F反应生成淡黄色固体(S),所以,C、F中都含有S,很容易想到2H2S+SO2====3S+2H2O。

 阅读快车系列答案
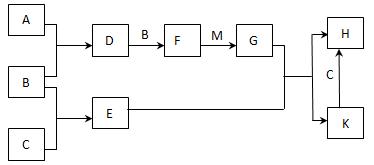
阅读快车系列答案已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见
的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液
体。各物质间的转化关系如下图所示(某些条件已略去)。
 |
请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 B. 还原性 C. 漂白性
(4)C与M在一定条件下反应的化学方程式为 。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为
。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品 吨。