题目内容
 科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有
科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有 键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子.
键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子.(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为
(2)由图乙石墨的晶体结构中,推算每个正六边形平均所占有的C原子数与C-C键数之比为
(3)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有
(4)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是
考点:晶胞的计算,化学键,键能、键长、键角及其应用
专题:化学键与晶体结构
分析:(1)金刚石、石墨、足球烯和碳纳米管都是由同种元素形成的不同单质;
(2)根据均摊法计算碳原子数和碳碳键数目;
(3)根据图象分析最小的环上碳原子个数;根据碳原子与其周围的碳原子形成的结构判断夹角;
(4)根据以上各物质的空间结构考虑.
(2)根据均摊法计算碳原子数和碳碳键数目;
(3)根据图象分析最小的环上碳原子个数;根据碳原子与其周围的碳原子形成的结构判断夹角;
(4)根据以上各物质的空间结构考虑.
解答:
解:(1)金刚石、石墨、足球烯和碳纳米管都是由同种元素形成的不同单质,互为同素异形体,故答案为:同素异形体;
(2)每个碳原子被三个碳环共有,每个碳环含有碳原子数为:
,;每条碳碳双键被两个碳环共有,每个碳环含有
条碳碳键,C原子数与C-C键数之比为2:3,
故答案为:2:3;
(3)金刚石是原子晶体,在原子晶体里,原子间以共价键相互结合,形成三维的空间网状结构,最小的环上有6个C原子;在金刚石晶体里,每个碳原子以四个共价键对称的与相邻的4个碳原子结合,碳原子采取sp3杂化方式形成共价键,所以碳原子与其周围的4个碳原子形成正四面体结构,所以夹角是 109°28′,
故答案为:6;109°28'( 或 109.5°);
(4)由于碳纳米管表面积大,可以用作贮氢材料,故答案为:碳纳米管.
(2)每个碳原子被三个碳环共有,每个碳环含有碳原子数为:
| 1 |
| 3 |
| 1 |
| 2 |
故答案为:2:3;
(3)金刚石是原子晶体,在原子晶体里,原子间以共价键相互结合,形成三维的空间网状结构,最小的环上有6个C原子;在金刚石晶体里,每个碳原子以四个共价键对称的与相邻的4个碳原子结合,碳原子采取sp3杂化方式形成共价键,所以碳原子与其周围的4个碳原子形成正四面体结构,所以夹角是 109°28′,
故答案为:6;109°28'( 或 109.5°);
(4)由于碳纳米管表面积大,可以用作贮氢材料,故答案为:碳纳米管.
点评:本题考查物质结构性质,为高频考点,侧重于学生的分析能力的考查,以碳元素的四种单质的空间结构图为中心命题点,综合了物质结构中相应的知识点,解决此题应具备一定的处理信息和空间想象能力,题目难度中等.

练习册系列答案
相关题目
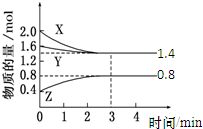 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.2 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3X(g)+Y(g)?2Z(g) |
| C、保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D、温度不变,增大X的浓度,该反应的平衡常数不变 |
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A、K+、MnO4-、SO42-、Cl- |
| B、Ca2+、HCO3-、NO3-、SO42- |
| C、K+、NO3-、SO42-、CO32- |
| D、Mg2+、SO42-、CO32-、Cl- |

 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH, 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题