��Ŀ����
����Ŀ��(1)��ˮɹ�������������ز�֮һ�����к���һ������CH3COOH��д��CH3COOH�ĵ��뷽��ʽ ______�����Ѵ�ƽ���������Һ�м���һ����CH3COONa ������ҺpH_______����������������С����������������
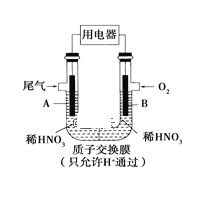
(2)ȼ�ϵ����������������ȼ�ϵ����������ʵ������Ⱦ�����ŷţ�����ϵͳ������������������ȡ֮��������֮����,���ȼ�ϵ��������Ϊ������ҵ��ע�Ľ��㡣ȼ�ϵ�ص�ȼ�Ͽ������������״��ȡ��пƼ�����������ϡ��������������Ϊ��������������˼״�������ȼ�ϵ�ء�����ϡ�������������ڸ������ܴ���O2-��
�ٸõ�ص�������Ӧ��___________��������Ӧ��____________��
����ϡ��������Ĺ��������У�O2-���ƶ�������__________��
�ۼ״���������ȼ����ȼ��ֱ�Ӳ��������ƶ����������У����Ƽ�������Ҫ���Ѵ����ľ����о��״�ȼ������,��Ҫԭ����___________��
(3)��AgCl�ı�����Һ�д��ڳ����ܽ�ƽ�⣺AgCl(s) ![]() Ag+(aq)+Cl-(aq)����25��ʱ,Ksp(AgCl)��1.8��10-10���ֽ������Ȼ����ֱ���룺
Ag+(aq)+Cl-(aq)����25��ʱ,Ksp(AgCl)��1.8��10-10���ֽ������Ȼ����ֱ���룺
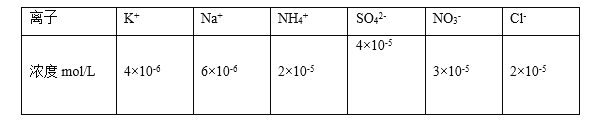
��100 mL����ˮ�У���100 mL 0.2 mol/L AgNO3��Һ�У���100 mL 0.1 mol/L�Ȼ�����Һ�У���100 mL 0.1 mol/L�����У���ֽ������ͬ�¶���c(Ag��)�ɴ�С��˳����_____(��д���)�����Т��������ӵ�Ũ��Ϊ______mol/L��
���𰸡�CH3COOH![]() CH3COO-+H+ ���� O2+4e-= 2O2- CH3OH+3O2--6e-=CO2��+2H2O ���������� ȼ�ϵ�ص�����ת���ʸ� �ڢ٢ܢ� 9��10-10
CH3COO-+H+ ���� O2+4e-= 2O2- CH3OH+3O2--6e-=CO2��+2H2O ���������� ȼ�ϵ�ص�����ת���ʸ� �ڢ٢ܢ� 9��10-10
��������
(1)CH3COOH��һԪ���ᣬ����Һ�д��ڵ���ƽ�⣻������Ũ�ȶԵ���ƽ���Ӱ�켰��ҺpH����������
(2)�ڼ״�ȼ�ϵ���ڣ�ͨ��״��ĵ缫Ϊ������ͨ������ĵ缫Ϊ��������������������Ӧ�������Ϸ�����ԭ��Ӧ��������е����������ƶ����������������ƶ���
(3) AgCl�ı�����Һ�д��ڳ����ܽ�ƽ�⣬��Ũ�ȵ�c(Cl-)��c(Ag��)��ƽ���ƶ���Ӱ����ͬ���ɸ���ƽ���ƶ�ԭ��������Һ��c(Ag��)����Դ�С��
(1) CH3COOH��һԪ���ᣬ����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO-+H+�������Һ�м���CH3COONa���ε��������CH3COO-ʹ��Һ��c(CH3COO-)������ƽ���ƶ�ԭ���������������Ũ�ȣ�pH�����ƶ�����Һ��c(H+)��С�������Һ��pH����
CH3COO-+H+�������Һ�м���CH3COONa���ε��������CH3COO-ʹ��Һ��c(CH3COO-)������ƽ���ƶ�ԭ���������������Ũ�ȣ�pH�����ƶ�����Һ��c(H+)��С�������Һ��pH����
(2)�ٸõ�ص�������Ӧ��O2��õ��ӱ�ΪO2-���缫��ӦʽΪO2+4e-= 2O2-��������CH3OHʧȥ���ӣ��������е�O2-����γ�CO2��ˮ����˸����ĵ缫��Ӧʽ��CH3OH+3O2--6e-=CO2��+2H2O��
����ϡ��������Ĺ��������У�O2-������ɽ϶�ĸ��������ƶ������ƶ������Ǵ�����������
�ۼ״���������ȼ����ȼ��ֱ�Ӳ��������ƶ�����������,���Ƽ�������Ҫ���Ѵ����ľ����о��״�ȼ����������Ҫԭ����ȼ�ϵ�ص�����ת���ʸߣ�
(3)��AgCl�ı�����Һ�д��ڳ����ܽ�ƽ�⣺AgCl(s)![]() Ag+(aq)+Cl-(aq)���������м���AgNO3��Һ����������Һ��Ag+��Ũ�ȣ������ܽ�ƽ�������ƶ������ܵ���˵ƽ���ƶ������������ģ��ﵽƽ�����Һ��c(Ag+)��ˮ�дۼ����Ȼ�����Һ����Һ��c(Cl-)����ƽ�������ƶ����ﵽƽ�����Һ��c(Ag+)�Ȣ��ܽ���ˮ��С�����ܽ���HCl�У�Ҳʹ��Һ��c(Cl-)����ƽ�������ƶ�������c(Cl-)�Ȣ�С�������������ñȢ��������մﵽƽ��ʱ��Һ��c(Ag+)�Ȣ۴�һЩ���ʳ�ֽ������ͬ�¶���c(Ag��)�ɴ�С��˳���Ǣڢ٢ܢۣ�
Ag+(aq)+Cl-(aq)���������м���AgNO3��Һ����������Һ��Ag+��Ũ�ȣ������ܽ�ƽ�������ƶ������ܵ���˵ƽ���ƶ������������ģ��ﵽƽ�����Һ��c(Ag+)��ˮ�дۼ����Ȼ�����Һ����Һ��c(Cl-)����ƽ�������ƶ����ﵽƽ�����Һ��c(Ag+)�Ȣ��ܽ���ˮ��С�����ܽ���HCl�У�Ҳʹ��Һ��c(Cl-)����ƽ�������ƶ�������c(Cl-)�Ȣ�С�������������ñȢ��������մﵽƽ��ʱ��Һ��c(Ag+)�Ȣ۴�һЩ���ʳ�ֽ������ͬ�¶���c(Ag��)�ɴ�С��˳���Ǣڢ٢ܢۣ�
���ڢ�100 mL 0.2 mol/L AgNO3��Һ��c(Ag��)=0.2mol/L������Ksp(AgCl)=1.8��10��10������c(Cl-)= Ksp(AgCl)��c(Ag��)= 1.8��10��10��0.2=9��10-10 mol/L��