题目内容
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z , 研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( ) 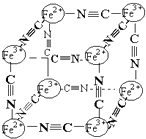
A.该晶体是原子晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3 , 且M为+1价
【答案】C
【解析】A、该晶体中含有Fe2+、Fe3+、CN﹣等阴阳离子,所以该晶体为离子晶体,故A错误; B、根据晶胞结构可知,晶胞中含有Fe2+的个数为4× ![]() =
= ![]() ,Fe3+的个数为4×
,Fe3+的个数为4× ![]() =
= ![]() ,CN﹣的个数为12×
,CN﹣的个数为12× ![]() =3,所以Fe2+、Fe3+、CN﹣的个数比为1:1:6,根据化合价代数和为零可知,M的化合价为+1价,故B错误;
=3,所以Fe2+、Fe3+、CN﹣的个数比为1:1:6,根据化合价代数和为零可知,M的化合价为+1价,故B错误;
C、根据晶胞结构,由B的计算可知,每个晶胞中含有Fe2+0.5个,Fe3+0.5个,CN﹣3个,由B可知M的化合价为+1价,根据化合价代数为零,可知每个晶胞平均含有M也是0.5个,而M的离子位于上述立方体的体心上,所以两个晶胞中一个有M+ , 而另一个必无M+ , 所以M+空缺率为50%,故C正确;
D、由B的分析可知,晶体的化学式可表示为MFe2(CN)6 , 且M为+1价,故D错误;
故选C.
A、该晶体中含有Fe2+、Fe3+、CN﹣等阴阳离子,据此判断晶体类型;
B、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断;
C、根据晶胞结构,利用均摊法确定晶胞中各离子个数比可判断;
D、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断.

【题目】在无色溶液中大量共存的一组离子是
A. Cu2+、SO42-、K+、Cl- B. Ag+、Cl-、OH-、Na+
C. NO3-、Cl-、Na+、Ca2+ D. NO3-、OH-、Mg2+、Na+
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 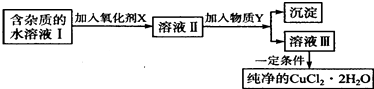
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
