��Ŀ����
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ��
��1�����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�ӦTaS2(s)+2I2(g) TaI4(g)+S2(g) ��H��0 ����Ӧ����ƽ�ⳣ������ʽK= ����K=1����ij�����ܱ������м���1mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ ��
TaI4(g)+S2(g) ��H��0 ����Ӧ����ƽ�ⳣ������ʽK= ����K=1����ij�����ܱ������м���1mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ ��
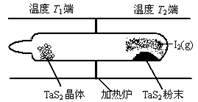
��2����ͼ��ʾ����Ӧ������ʯӢ��չ��н��У������¶�ΪT2��һ�˷���δ�ᴿ��TaS2��ĩ������I2��g����һ��ʱ������¶�ΪT1��һ�˵õ��˴�����TaS2���壬���¶�T1 T2���������������=������������Ӧ��ϵ��ѭ��ʹ�õ������� ��
��3������I2�������Կɲⶨ��������ĺ����������ǽ������е���ת��Ϊ H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ ���ζ���Ӧ�����ӷ���ʽΪ ��
��4��25��ʱ��H2SO3 HSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh= mol/L������NaHSO3��Һ�м���������I2������Һ��
HSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh= mol/L������NaHSO3��Һ�м���������I2������Һ��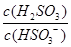 �� ���������С�����䡱����
�� ���������С�����䡱����
��1�����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�ӦTaS2(s)+2I2(g)
 TaI4(g)+S2(g) ��H��0 ����Ӧ����ƽ�ⳣ������ʽK= ����K=1����ij�����ܱ������м���1mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ ��
TaI4(g)+S2(g) ��H��0 ����Ӧ����ƽ�ⳣ������ʽK= ����K=1����ij�����ܱ������м���1mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ ����2����ͼ��ʾ����Ӧ������ʯӢ��չ��н��У������¶�ΪT2��һ�˷���δ�ᴿ��TaS2��ĩ������I2��g����һ��ʱ������¶�ΪT1��һ�˵õ��˴�����TaS2���壬���¶�T1 T2���������������=������������Ӧ��ϵ��ѭ��ʹ�õ������� ��

��3������I2�������Կɲⶨ��������ĺ����������ǽ������е���ת��Ϊ H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ ���ζ���Ӧ�����ӷ���ʽΪ ��
��4��25��ʱ��H2SO3
 HSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh= mol/L������NaHSO3��Һ�м���������I2������Һ��
HSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh= mol/L������NaHSO3��Һ�м���������I2������Һ��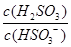 �� ���������С�����䡱����
�� ���������С�����䡱������1��
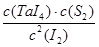 ��66.7%��
��66.7%����2������ I2��
��3�����ۣ� H2SO3+I2+H2O=2I��+SO42��+4H����
��4��1.0��10��12������
��1����������Ļ�ѧ����ʽ��TaS2��s��+2I2��g��
 TaI4��g��+S2��g������֪K=
TaI4��g��+S2��g������֪K=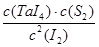 ������K=1����ƽ��ʱTaI4��S2�����ʵ���Ϊx�������ƽ�ⳣ������ʽ����x/V��2=����1-2x��/V��2������x2=��1-2x��2�����x=1/3����I2��g����ƽ��ת����Ϊ��(2/3)��100%=66.7%��
������K=1����ƽ��ʱTaI4��S2�����ʵ���Ϊx�������ƽ�ⳣ������ʽ����x/V��2=����1-2x��/V��2������x2=��1-2x��2�����x=1/3����I2��g����ƽ��ת����Ϊ��(2/3)��100%=66.7%����2����������Ļ�ѧ����ʽ��TaS2��s��+2I2��g��
 TaI4��g��+S2��g�� ��H��0���÷�Ӧ�������ȣ����ڷ�Ӧ����T2�˿�ʼ��һ��ʱ�����T1�˵õ����壬˵����Ӧ���ɵ�������T1���¶Ƚ���ƽ�����ƣ����¶�T1��T2���������仯������I2����ѭ��ʹ�ã�
TaI4��g��+S2��g�� ��H��0���÷�Ӧ�������ȣ����ڷ�Ӧ����T2�˿�ʼ��һ��ʱ�����T1�˵õ����壬˵����Ӧ���ɵ�������T1���¶Ƚ���ƽ�����ƣ����¶�T1��T2���������仯������I2����ѭ��ʹ�ã���3������I2�������Կɲⶨ��������ĺ���ʱ��ָʾ���ǵ��ۣ���Ӧ�����ӷ���ʽΪ��H2SO3+I2+H2O= 2I��+SO42��+4H����
��4������NaHSO3��ˮ�ⷽ��ʽ��HSO3-+H2O
 H2SO3+OH������ˮ��ƽ�ⳣ���ı���ʽΪ��Kh=c(H2SO3)��c(OH��)/c(HSO3-)����Ka��Kh= c(H+)��c(OH��)=Kw�������Kh =1.0��10��12������NaHSO3��Һ�м���������I2����Һ�з�����Ӧ��HSO32-+I2+H2O=SO42-+2I-+3H+�������ӽ�����������ӣ�ʹƽ�������ƶ��������Һ��
H2SO3+OH������ˮ��ƽ�ⳣ���ı���ʽΪ��Kh=c(H2SO3)��c(OH��)/c(HSO3-)����Ka��Kh= c(H+)��c(OH��)=Kw�������Kh =1.0��10��12������NaHSO3��Һ�м���������I2����Һ�з�����Ӧ��HSO32-+I2+H2O=SO42-+2I-+3H+�������ӽ�����������ӣ�ʹƽ�������ƶ��������Һ��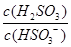 ����
���������㶨λ�������ۺϿ����˻�ѧƽ�ⳣ��������ƽ�ⳣ����ˮ��ƽ�ⳣ����ƽ��ת���ʡ���ѧƽ����ƶ����ζ�ָʾ����ѡ���֪ʶ��

��ϰ��ϵ�д�
�����Ŀ
 2SO3(g)��������Щ�����ٱ仯ʱ��������˵����ѧ��Ӧ�Ѵ�ƽ��״̬(�� ��)
2SO3(g)��������Щ�����ٱ仯ʱ��������˵����ѧ��Ӧ�Ѵ�ƽ��״̬(�� ��) 2Z(g)�ﵽ�ȵı�־�ǣ� ��
2Z(g)�ﵽ�ȵı�־�ǣ� �� H2S(g) K1��
H2S(g) K1�� SO2(g) K2������ͬ�¶��·�ӦH2(g)+SO2(g)
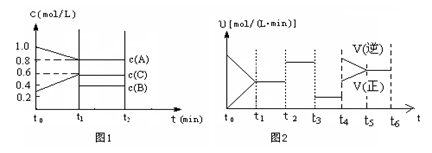
SO2(g) K2������ͬ�¶��·�ӦH2(g)+SO2(g)  H2��g��+I2��g�����ܱ������н��У���__________����ʱ��仯ʱ������˵����Ӧ�Ѵﵽƽ�⣨ ��
H2��g��+I2��g�����ܱ������н��У���__________����ʱ��仯ʱ������˵����Ӧ�Ѵﵽƽ�⣨ ��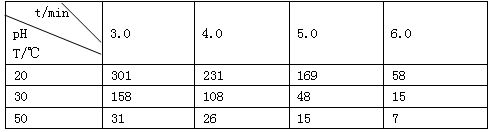
 CH3OH(g)��Ӧ�ϳɼ״���
CH3OH(g)��Ӧ�ϳɼ״���
 B��C����ijһ�¶�ʱ���ﵽƽ�⡣
B��C����ijһ�¶�ʱ���ﵽƽ�⡣  2NH3��g������N2��H2��NH3����ʼŨ�ȷֱ�ΪC1��C2��C3������Ϊ�㣩������ƽ��ʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1���������ж���ȷ���ǣ� ��
2NH3��g������N2��H2��NH3����ʼŨ�ȷֱ�ΪC1��C2��C3������Ϊ�㣩������ƽ��ʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1���������ж���ȷ���ǣ� ��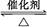 2SO3(g)����H��0��ij�о�С���о������������²���ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����(����)
2SO3(g)����H��0��ij�о�С���о������������²���ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����(����)