题目内容
以粗盐(主要成分为NaCl,含少量Ca2+、Mg2+、Fe3+、SO 等)为原料制备亚氯酸钠(NaClO2)的工艺如下(试剂A为依次加入的过量BaCl2、NaOH、Na2CO3溶液):
等)为原料制备亚氯酸钠(NaClO2)的工艺如下(试剂A为依次加入的过量BaCl2、NaOH、Na2CO3溶液):
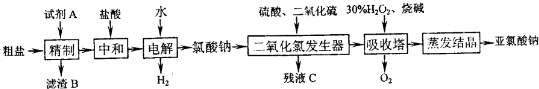
回答下列问题:
(1)“精制”过程中,加入过量的Na2CO3的作用是______.
(2)电解时发生主要反应的离子方程式为______;该过程中有少量有毒气体单质产生.可用碱液吸收,该气体为______(填化学式).
(3)二氧化氯发生器中发生的化学反应,其氧化剂和还原剂的物质的量之比为______.
(4)吸收塔中发生反应的化学方程式为______;二氧化氯气体和H2O2需稍过量,其目的是______.
解:(1)“精制”过程中,加入过量的Na2CO3可将Ca2+、Ba2+完全转化为沉淀,其作用为除去Ca2+和过量的Ba2+,故答案为:除去Ca2+和过量的Ba2+;
(2)电解NaCl溶液,生成氢气、氯酸钠,离子反应为Cl-+3H2O ClO3-+3H2↑,氯气(Cl2)能被碱液吸收,故答案为:Cl-+3H2O
ClO3-+3H2↑,氯气(Cl2)能被碱液吸收,故答案为:Cl-+3H2O ClO3-+3H2↑;Cl2;
ClO3-+3H2↑;Cl2;
(3)二氧化氯发生器中,Cl元素的化合价由+5价降低为+4价,S元素的化合价由+4价升高为+6价,氯酸钠为氧化剂,二氧化硫为还原剂,由电子守恒可知,氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
(4)吸收塔中发生二氧化氯与过氧化氢、NaOH的氧化还原反应,生成水、氧气、亚氯酸钠,该反应为2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,二氧化氯气体和H2O2需稍过量,可使NaOH完全反应,便于产物提纯,故答案为:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2;使NaOH完全反应,便于产物提纯.
分析:(1)“精制”过程中,加入过量的Na2CO3的作用,可将Ca2+、Ba2+完全转化为沉淀;
(2)电解NaCl溶液,生成氢气、氯气、NaOH,氯气能被碱液吸收;
(3)二氧化氯发生器中,Cl元素的化合价由+5价降低为+4价,S元素的化合价由+4价升高为+6价;
(4)吸收塔中发生二氧化氯与过氧化氢、NaOH的氧化还原反应,生成水、氧气、亚氯酸钠,氧化氯气体和H2O2需稍过量,可使NaOH完全反应,便于产物提纯.
点评:本题考查物质的制备及混合物分离和提纯,明确流程中的方法和基本操作、发生的化学反应是解答的关键,要求学生具有分析和解决问题的能力,题目难度较大.
(2)电解NaCl溶液,生成氢气、氯酸钠,离子反应为Cl-+3H2O
 ClO3-+3H2↑,氯气(Cl2)能被碱液吸收,故答案为:Cl-+3H2O
ClO3-+3H2↑,氯气(Cl2)能被碱液吸收,故答案为:Cl-+3H2O ClO3-+3H2↑;Cl2;
ClO3-+3H2↑;Cl2;(3)二氧化氯发生器中,Cl元素的化合价由+5价降低为+4价,S元素的化合价由+4价升高为+6价,氯酸钠为氧化剂,二氧化硫为还原剂,由电子守恒可知,氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
(4)吸收塔中发生二氧化氯与过氧化氢、NaOH的氧化还原反应,生成水、氧气、亚氯酸钠,该反应为2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,二氧化氯气体和H2O2需稍过量,可使NaOH完全反应,便于产物提纯,故答案为:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2;使NaOH完全反应,便于产物提纯.
分析:(1)“精制”过程中,加入过量的Na2CO3的作用,可将Ca2+、Ba2+完全转化为沉淀;
(2)电解NaCl溶液,生成氢气、氯气、NaOH,氯气能被碱液吸收;
(3)二氧化氯发生器中,Cl元素的化合价由+5价降低为+4价,S元素的化合价由+4价升高为+6价;
(4)吸收塔中发生二氧化氯与过氧化氢、NaOH的氧化还原反应,生成水、氧气、亚氯酸钠,氧化氯气体和H2O2需稍过量,可使NaOH完全反应,便于产物提纯.
点评:本题考查物质的制备及混合物分离和提纯,明确流程中的方法和基本操作、发生的化学反应是解答的关键,要求学生具有分析和解决问题的能力,题目难度较大.

练习册系列答案
相关题目
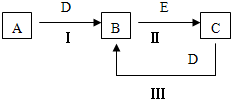 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.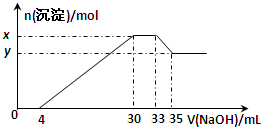 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示.下列叙述正确的是
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示.下列叙述正确的是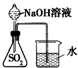

 Ca2++2NH3↑+2H2O
Ca2++2NH3↑+2H2O