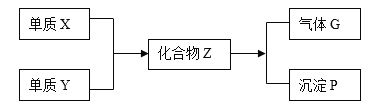
题目内容
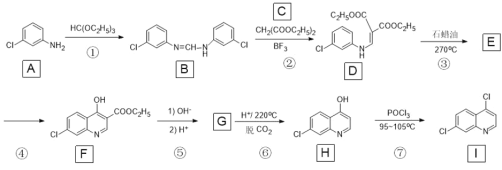
【题目】临床结果显示,磷酸氯喹对新冠肺炎有一定诊疗效果。化合物 I 是合成磷酸氯喹的中间体,一种合成路线如下:
回答下列问题:
(1)A 中的官能团名称是______________。
(2)C 的化学名称为________________。
(3)⑦的反应类型是___________________。
(4)已知③为取代反应,另一生成物为乙醇,E 的结构简式为_____________________;
(5)写出 F 与足量NaOH 溶液反应的化学方程式__________________;
(6)H 在一定条件下可以转化为 M( ),请写出任意一种同时符合下列条件 M 的同分异构体__________________;①含有-NH2 的芳香族化合物; ②核磁共振氢谱共有 4 组峰
),请写出任意一种同时符合下列条件 M 的同分异构体__________________;①含有-NH2 的芳香族化合物; ②核磁共振氢谱共有 4 组峰
(7)设计以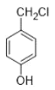 (对羟基苄基氯)、CH3CH2OH 为主要原料制备
(对羟基苄基氯)、CH3CH2OH 为主要原料制备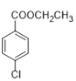 的合成路线________。
的合成路线________。
【答案】氨基、氯原子 丙二酸二乙酯 取代反应 ![]()
![]() +NaOH
+NaOH![]()
![]() + CH3CH2OH
+ CH3CH2OH  (或其他正确答案均可)
(或其他正确答案均可) 
![]()

![]()

![]()

![]()

【解析】
A发生取代反应生成B,B和丙二酸二乙酯反应生成D,D发生取代反应生成E(![]() ),
),![]() 经过反应生成F,F发生水解反应、酸化得到G,G发生脱CO2反应得到H,H发生取代反应得到I。
经过反应生成F,F发生水解反应、酸化得到G,G发生脱CO2反应得到H,H发生取代反应得到I。
(7)以对羟基苄氯(![]() )、CHCH2OH为主要原料制备(
)、CHCH2OH为主要原料制备( ),
),![]() 发生取代反应、水解反应、氧化反应得到对氯苯甲酸,对氯苯甲酸发生酯化反应得到目标产物。
发生取代反应、水解反应、氧化反应得到对氯苯甲酸,对氯苯甲酸发生酯化反应得到目标产物。
(1)A 中的官能团名称是氨基、氯原子;故答案为:氨基、氯原子。
(2)根据C的结构简式得到C的化学名称为丙二酸二乙酯;故答案为:丙二酸二乙酯。
(3)根据反应⑦前后的结构简式分析,H中—OH被I中—Cl取代,因此反应类型是取代反应;故答案为:取代反应。
(4)已知③为取代反应,另一生成物为乙醇,根据D反应生成乙醇和E,得到E 的结构简式为![]() ;故答案为:
;故答案为:![]() 。
。
(5)F与足量NaOH溶液反应的化学方程式![]() +NaOH
+NaOH![]()
![]() + CH3CH2OH;故答案为:
+ CH3CH2OH;故答案为:![]() +NaOH
+NaOH![]()
![]() + CH3CH2OH。
+ CH3CH2OH。
(6)H 在一定条件下可以转化为 M( ),请写出任意一种同时符合下列条件 M 的同分异构体
),请写出任意一种同时符合下列条件 M 的同分异构体 ;故答案为:
;故答案为: (或其他正确答案均可)。
(或其他正确答案均可)。
(7) 在POCl3作用下反应生成
在POCl3作用下反应生成 ,
, 在碱性条件下水解生成
在碱性条件下水解生成 ,
, 催化氧化变为
催化氧化变为 ,
, 和乙醇发生酯化反应生成
和乙醇发生酯化反应生成 ,其流程图为:
,其流程图为:
![]()

![]()

![]()

![]()
 ;故答案为:
;故答案为:
![]()

![]()

![]()

![]()
 。
。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】I.(1)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
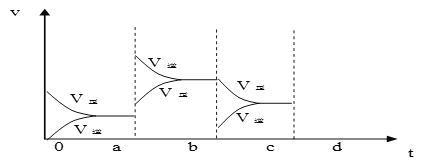
(3)对于下列电离平衡:NH3·H2O![]() NH4+ + OH -,能使c(NH4+)增大的措施是:_________
NH4+ + OH -,能使c(NH4+)增大的措施是:_________
①升高温度 ②加氨气 ③水 ④ NH4Cl溶液 ⑤NaOH溶液 ⑥适量的盐酸
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________;
(2)该反应为____________反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为____________℃;
(4)830℃时,向该容器中加入1LCO2与1LH2,平衡时CO2的体积分数是____________。
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/molL-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为_______,试样的pH=_______。
(2)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。已知:
H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
C(s)+![]() O2(g)=CO(g)ΔH=-110.5kJ·mol-1
O2(g)=CO(g)ΔH=-110.5kJ·mol-1
则C(s)+H2O(g)=CO(g)+H2(g)的ΔH=________kJ·mol-1。
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) ΔH>0,若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol,计算该温度下的平衡常数K=_______。汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是________。
2NO(g) ΔH>0,若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol,计算该温度下的平衡常数K=_______。汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据:_________。