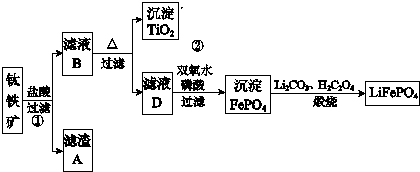
题目内容
7. 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
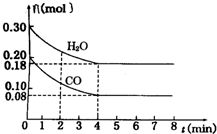
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)(1)CO和H2O浓度变化如图,则0-4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
(2)如图中4-5min该反应是(填“是”或“否”)处于平衡状态,判断理由CO和H2O的浓度不再随着时间的变化而变化
(3)下列叙述也能说明上述反应达到平衡状态的是D.
A.反应中CO与H2O的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amol CO,同时生成a mol H2O E.混合气体的压强不随时间的变化而变化.
分析 (1)根据υ=$\frac{△c}{△t}$计算反应速率;
(2)根据图象中反应物的浓度变化分析;根据判断平衡状态的方法分析;
(3)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不发生变化.
解答 解:(1)υ=$\frac{△c}{△t}$=$\frac{0.20mol/l-0.08mol/L}{4min}$=0.03mol/(L•min),故答案为:0.03;
(2)由图象可知4~5min时,CO和H2O的浓度不再随着时间的变化而变化,反应达到平衡状态,故答案为:是;CO和H2O的浓度不再随着时间的变化而变化;
(3)A.反应中CO与H2O的物质的量之比为1:1,并不是不变的状态,故错误;
B.质量守恒,所以混合气体的总质量一直不随时间的变化而变化,不一定平衡,故错误;
C.气体两边的计量数相等,所以混合气体的总物质的量一直不随时间的变化而变化,故错误;
D.单位时间内每消耗amol CO相当于消耗amolH2O,同时生成a mol H2O,所以正逆反应速率相等,达平衡状态,故正确;
E.气体两边的计量数相等,所以混合气体的压强一直不随时间的变化而变化,故错误;故选D.
点评 本题考查了反应速率的计算、平衡状态的判断,题目比较基础,难度不大.

练习册系列答案
相关题目
15.下列表示的是N原子的轨道表示式: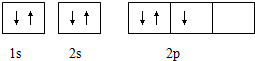 它违背了( )
它违背了( )
 它违背了( )
它违背了( )| A. | 能量守恒原理 | B. | 能量最低原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
2.将纯锌片和纯铜片用导线连接后放入稀硫酸中发生原电池反应,下列叙述正确的是( )
| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
12.下列叙述正确的是( )
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 某元素原子最外层只有两个电子,它一定是金属元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
19.下列各组物质互为同系物的是( )
| A. | O2,O3 | B. | ${\;}_{6}^{13}$C,${\;}_{6}^{12}$C | C. | 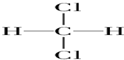 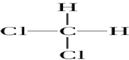 | D. | CH3CH3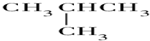 |
16.设NA表示阿佛加德罗常数的值,下列说法不正确的是( )
| A. | 1molD(氘)的质量与NA个T(氚)的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比为16:1 | |
| C. | 28g氮气所含原子数目为2NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L |
17.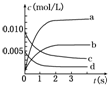 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,SO2的转化率为65%;
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.