��Ŀ����
����Ŀ��Ϊ��ȥ�����е�Ca2����Mg2����SO42- �Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽������������(���ڳ������Լ��Թ���)��
![]()
(1)�ж�BaCl2�ѹ����ķ�����_______________________________________________��
(2)�ڢܲ��У���ص����ӷ���ʽ��___________________________________________��
(3)�����������ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ����______________________________��
(4)Ϊ���龫�δ��ȣ�������150 mL 0.2 mol/L NaCl(����)��Һ����ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ�����еĴ�����____________________________________________��

���𰸡� ȡ�ϲ���Һ��������BaCl2���������� Ca2����CO32-��CaCO3����Ba2����CO32-��BaCO3�� ������ǰ��������ǰ�������ɵij����ᱻ������Һ���±�Ϊ���ӽ�����Һ ת��Һ��ʱû���ò���������������ƿ�õ���100 mLӦ����150 mL
��������(1). �������Ȼ����Ὣ��������ӳ�����ȫ�������������ʣ�࣬���Ȼ��������䷴Ӧ���ְ�ɫ�����������ж�BaCl2�ѹ����ķ����ǣ�ȡ�ϲ���Һ����ȡ�����ϲ���Һ���Թ��У����ٵ�������BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ������ʴ�Ϊ��ȡ���ϲ���Һ��������BaCl2��Һ������������
(2). ���ε��ᴿ��������̼���Ƶ������dz�ȥ�������Լ���ǰ�����ı���������Ӧ�����ӷ���ʽΪ��Ca2++CO32=CaCO3����Ba2++CO32=BaCO3�����ʴ�Ϊ��Ca2++CO32=CaCO3����Ba2++CO32=BaCO3����
(3). ���ȼ������ٹ����� ��ǰ�����ɵ�Mg(OH)2��CaCO3��BaCO3�����������ᷴӦ�����������ֽ�����Һ���Ӷ�Ӱ���Ȼ��ƵĴ��ȣ��ʴ�Ϊ��������ǰ�����ᣬǰ�������ɵij����ᱻ������Һ���±�Ϊ���ӽ�����Һ��
(4). ����ͼʾ������ȱ�ٲ���������������ƿ�Ĺ��Ҳ���ԣ�����ƿ�õ���100mLӦ����150mL���ʴ�Ϊ��ת��Һ��ʱû���ò���������������ƿ�õ���100mLӦ����150mL��

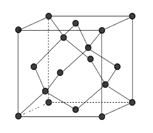
 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֡�����Ԫ���ڱ��е�λ�ã����û�ѧ����ش���������:
�� ���� | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
4 | �� | |||||||
5 | �� |
��1�������ۺ�����Ļ�ѧʽΪ_________��
��2���ٺ͢�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĽṹʽΪ_________��
��3���ۢܢߢ�ļ�����뾶�ɴ�С��˳��Ϊ_________��(�����ӷ��ű�ʾ)
��4���ڢܵ�����������ˮ����֮�䷢����Ӧ�����跽��ʽ_________��
��5���õ���ʽ��ʾ�ۺ͢���ɵĻ�������γɹ���_________��
��6�������к��Т�Ԫ�أ��������к��и�Ԫ�صļ������ӡ��������ữ�£�����˫��ˮ��������Ϊ���ʡ�д���÷�Ӧ�����ӷ���ʽ_________��