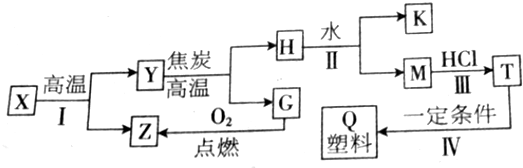
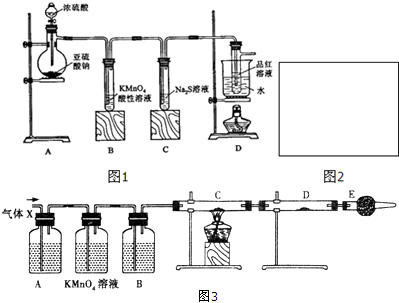
题目内容
18.蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2.(1)此蓄电池放电时,电池中某一电极上发生氧化反应的物质是B.
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)以此蓄电池为电源,用石墨作电极,电解含有大量浓度相同的下列离子的溶液:Al3+、Cu2+、Cl-,SO42-,阴极上最先放电的离子是Cu2+,开始时,阳极的电极反应式为2Cl--2e-=Cl2↑.
(3)用此蓄电池分别电解以下两种溶液,若电路中转移了0.02mol电子(电解池的电极为惰性电极),试回答下列问题:
①电解足量Cu(NO3)2溶液时,某一电极增加的质量为0.64g.
②电解Na2SO4溶液,阴极的电极反应式为2H++2e-=H2↑,阳极产生的气体在标准情况下的体积为0.112L.
分析 (1)由方程式可知,放电时,Fe被氧化生成Fe(OH)2,Fe为负极;
(2)电解时,氧化性最强的阳离子首先在阴极放电,阳极发生氧化反应,氯离子被氧化生成氯气;
(3)①电解足量Cu(NO3)2溶液时,电极增加的为阴极,发生Cu2++2e-=Cu;
②电解Na2SO4溶液,阴极生成氢气,阳极生成氧气,结合电极方程式计算.
解答 解:(1)由方程式可知,放电时,Fe被氧化生成Fe(OH)2,Fe为负极,电极上发生氧化反应的物质是Fe,故答案为:B;
(2)电解时,Cu2+首先在阴极放电,阳极发生氧化反应,溶液中含有氯离子,氯离子被氧化生成氯气,电极方程式为2Cl--2e-=Cl2↑,
故答案为:Cu2+;2Cl--2e-=Cl2↑;
(3)若电路中转移了0.02mol电子,
①电解足量Cu(NO3)2溶液时,电极增加的为阴极,发生Cu2++2e-=Cu,可知生成0.01molCu,质量为0.01mol×64g/mol=0.64g,故答案为:0.64g;
②电解Na2SO4溶液,阴极生成氢气,电极方程式为2H++2e-=H2↑,阳极生成氧气,电极方程式为4OH-+2H2O-4e-=O2↑,可知生成0.005molO2,体积为0.005mol×22.4L/mol=0.112L,
故答案为:2H++2e-=H2↑;0.112L.
点评 本题考查原电池和电解池知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握电极方程式的书写,为解答该题的关键,也是易错点,做题时注意体会.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
8.能说明某烃分子里含有碳碳不饱和键的是( )
| A. | 分子组成中含碳氢原子个数比为1:2 | |
| B. | 能与溴发生加成反应而使溴水褪色,还能使酸性KMnO4溶液褪色 | |
| C. | 在空气中燃烧能产生黑烟 | |
| D. | 完全燃烧生成等物质的量的CO2和H2O |
9.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和冰的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 氯化钠和冰融化 |
6.下列表示物质结构的化学用语正确的是( )
| A. | 氯化氢的电子式: | B. | CO2的结构式:O=C=O | ||
| C. | 硫离子结构示意图: | D. | CCl4的电子式: |
15.已知:S(l)+O2(g)=SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
 O2
O2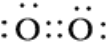 NH4+
NH4+ Na2O2
Na2O2
 CH4:
CH4: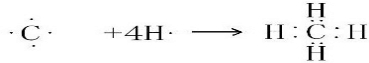 .
.