题目内容
某同学从资料上查到以下反应:

A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色
回答下列问题:
(1)①B元素的原子结构示意图为
 ;
;
②若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,写出此反应的离子方程式
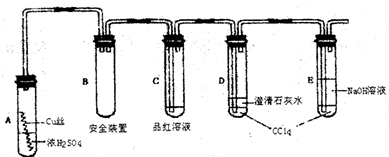
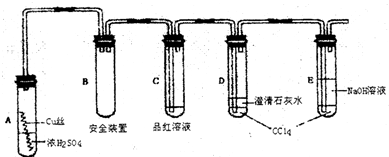
(2)若要检验产物中的AO2,最后的气体产物应依次通过哪三种试剂

A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色
回答下列问题:
(1)①B元素的原子结构示意图为


②若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
1:1
1:1
;③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,写出此反应的离子方程式
2ClO3-+SO2=2ClO2+SO42-
2ClO3-+SO2=2ClO2+SO42-
.(2)若要检验产物中的AO2,最后的气体产物应依次通过哪三种试剂
高锰酸钾溶液,品红溶液,氢氧化钙溶液
高锰酸钾溶液,品红溶液,氢氧化钙溶液
.分析:A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色,可以推断BO2为SO2,AO2为CO2;确定A为C,B为S;依据推断出的物质分析选项内容.
解答:解:A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色,可以推断BO2为SO2,AO2为CO2;确定A为C,B为S;
(1)①B元素为S元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
②若反应中A为C和B为S的质量比为3:4,物质的量之比=
:
=2:1;依据原子守恒配平化学方程式得到;2KClO3+2C+S=2KCl+2CO2+SO2,
得到n(KClO3):n(CO2)=1:1,故答案为:1:1;
③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,依据氧化还原反应的电子守恒和原子守恒写出离子方程式为2ClO3-+SO2=2ClO2+SO42-,
故答案为:2ClO3-+SO2=2ClO2+SO42-;
(2)若要检验产物中的CO2,因为二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以先把二氧化硫用高锰酸钾溶液吸收,再检验二氧化硫的存在,最后用澄清石灰水检验二氧化碳的存在;所以最后的气体产物应依次通过以下三种试剂:高锰酸钾溶液,品红溶液,氢氧化钙溶液,
故答案为:高锰酸钾溶液,品红溶液,氢氧化钙溶液;
(1)①B元素为S元素,原子结构示意图为
 ,故答案为:
,故答案为: ;
;②若反应中A为C和B为S的质量比为3:4,物质的量之比=
| 3 |
| 12 |
| 4 |
| 32 |
得到n(KClO3):n(CO2)=1:1,故答案为:1:1;
③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,依据氧化还原反应的电子守恒和原子守恒写出离子方程式为2ClO3-+SO2=2ClO2+SO42-,
故答案为:2ClO3-+SO2=2ClO2+SO42-;
(2)若要检验产物中的CO2,因为二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以先把二氧化硫用高锰酸钾溶液吸收,再检验二氧化硫的存在,最后用澄清石灰水检验二氧化碳的存在;所以最后的气体产物应依次通过以下三种试剂:高锰酸钾溶液,品红溶液,氢氧化钙溶液,
故答案为:高锰酸钾溶液,品红溶液,氢氧化钙溶液;
点评:本题考查了物质转化关系的分析判断,物质性质的应用,物质的特征性质是判断的主要依据,氧化还原反应的电子守恒和原子守恒是书写离子方程式和化学方程式的依据,题目难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 Cu(OH)2+2H+
Cu(OH)2+2H+
 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①
 Cu2S(黑色)
Cu2S(黑色)