题目内容
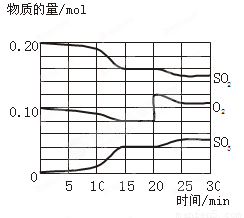
(12分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
(12分)(每空2分)(1)增大 (2) 15—20min、25—30min 。
(3) 增大氧气的浓度,a、b。(第二空2分,多选不给分) (4)不 、向左。
【解析】(1)因为正反应是放热反应,所以降低温度,平衡锌正反应方向移动,平衡常数增大。
(2)平衡时物质的浓度是不变的,所以根据图像可知,反应处于平衡状态的时间段为15~20min和25~30min。
(3)根据图像可知,反应进行至20 min时,氧气的瞬间增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的体积是增大氧气浓度,平衡向正反应方向移动。10 min到15 min时反应还没有达到平衡状态,但反应速率明显加快,所以改变的条件是ab。
(4)体积不变,则浓度不变,所以平衡不移动。维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则相当于降低压强,平衡向逆反应方向移动。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
 CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题: