题目内容
碳酸钠和碳酸氢钠是重要的工业原料。某学生活动小组为探究它们的性质并测定某天然碱的成分进行了下述实验。Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)_________。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是__________________。
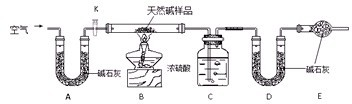
Ⅱ.某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为

请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明_______________________。
(2)NaHCO3受热分解的化学反应方程式为________________________________________。
(3)E处碱石灰的作用是__________________________________________________。
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是__________________。
(5)实验结束后称得洗气瓶C质量增加
Ⅰ.![]() +H2O
+H2O![]()
![]() +OH- 产生白色沉淀,且溶液红色褪去
+OH- 产生白色沉淀,且溶液红色褪去
Ⅱ.(1)样品重于砝码
(2)2NaHCO3![]() Na2CO3+H2O+CO2↑(条件加热)
Na2CO3+H2O+CO2↑(条件加热)
(3)防止空气中的CO2和水蒸气进入U形管D中
(4)使反应产生的CO2和水蒸气被充分吸收
(5)Na2CO3·2NaHCO3·H2O
解析:Ⅰ.![]() +H2O
+H2O![]()
![]() +OH-,酚酞试液显红色,加过量CaCl2,Ca2++
+OH-,酚酞试液显红色,加过量CaCl2,Ca2++![]()
![]() CaCO3↓,溶液红色褪去.
CaCO3↓,溶液红色褪去.
Ⅱ.该实验通过测天然碱受热分解生成的CO2和H2O的质量,确定天然碱的成分.
洗气瓶C吸收样品分解生成的H2O,U形管D吸收NaHCO3分解生成的CO2.
(5)m总(H2O)=
2NaHCO3 ![]() CO2↑+H2O+Na2CO3
CO2↑+H2O+Na2CO3
2×
m(NaHCO3)=
所以
a:b:c=![]() =1:2:1
=1:2:1
即天然碱的化学式为Na2CO3·2NaHCO3·H2O.

Ⅰ.兴趣小组设计三种方案,鉴别浓度均为0.01mol?L-1碳酸钠和碳酸氢钠两种溶液:
| 序号 | 甲 | 乙 | 丙 |
| 方案 | 用广泛pH试纸 检测溶液pH |
滴加等体积0.1mol?L-1 Ba(OH)2溶液 |
滴加等体积0.1mol?L-1 CaCl2溶液 |
(2)结果表明方案乙无法实现鉴别目的,用离子方程式表示方案乙发生的反应:
(3)经过查阅资料获得如下信息:Ksp(CaCO3)=4.96×10-9;0.01mol?L-1 NaHCO3、Na2CO3溶液中
c(CO32-)如表所示:
| 0.01mol?L-1溶液 | NaHCO3 | Na2CO3 |
| c(CO32-)/mol?L-1 | 0.00011 | 0.0087 |
Ⅱ.纯碱生产过程中,所得产品往往混有一定量的氯化钠.为检测纯碱的纯度,可采用多种方案来进行.
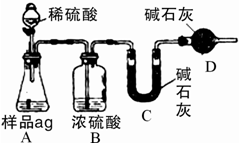
(4)如图为学生丁设计的方案,试图通过测定样品(a g)与足量的稀硫酸反应产生的CO2质量来实现目的.
①本方案存在缺陷,对纯碱纯度检测的影响.
缺陷:
②方案经改进后,丁进行了实验,并测得B、C、D三套装置的质量分别增重了m1、m2和m3.则纯碱的纯度为
(5)现只有少量(约1g)纯碱样品、0.100mol?L-1硫酸和蒸馏水,同学戊拟通过测定一定质量的纯碱样品与硫酸反应时消耗硫酸体积来确定纯碱的纯度.实验过程中,需用