题目内容
15.下列关于元素周期表和元素周期律的说法错误的是( )| A. | Li、Na、K元素原子的核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 因为Na比K容易失电子,所以Na比K的还原性强 | |
| D. | F与Cl为同主族的元素,且F比Cl的非金属性强 |
分析 A.碱金属元素从上到下电子层增多;
B.同周期从左向右非金属性增强;
C.碱金属从上到下金属性增强;
D.同主族从上到下非金属性减弱.
解答 解:A.碱金属元素从上到下电子层增多,则Li、Na、K元素原子的核外电子层数随着核电荷数的增加而增多,故A正确;
B.同周期从左向右非金属性增强,则第二周期元素从Li到F,非金属性逐渐增强,故B正确;
C.碱金属从上到下金属性增强,则K比Na易失去电子,K的还原性比Na的还原性强,故C错误;
D.同主族从上到下非金属性减弱,则F与Cl为同主族的元素,且F比Cl的非金属性强,故D正确;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
6.粗盐中往往含有Ca2+、Mg2+、SO42-,为了有效除去该杂质离子,加入试剂的合理顺序为( )
| A. | 先加NaOH,后加Na2CO3,再加BaCl2 | B. | 先加NaOH,后加BaCl2,再加Na2CO3 | ||
| C. | 先加Na2CO3,后加NaOH,再加BaCl2 | D. | 先加Na2CO3,后加BaCl2,再加NaOH |
3.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序、若以E表示某能级的能量,下列能量大小顺序中正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
10.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 硼的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt见光容易分解,但不溶于水也不溶于稀酸 | |
| C. | 氢氧化铷(RbOH)易溶于水 | |
| D. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
20.2007年6月5日各大媒体报道了中国在南海北部成功钻获天然气水合物实物样品“可燃冰”,从而成为继美国、日本、印度之后第4个通过国家级研发计划采到水合物实物样品的国家.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.关于“可燃冰”的叙述不正确的是( )
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成份是甲烷 |
7.根据氧族元素的性质推断,硒不可能具有的性质是( )
| A. | 单质易溶于水 | B. | 最高价氧化物对应水化物是酸 | ||
| C. | 单质既有氧化性又有还原性 | D. | 气态氢化物的稳定性较H2S弱 |
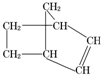 降冰片烯的分子结构如图:
降冰片烯的分子结构如图:
 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$ 

 I:
I: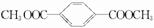 .
. +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$ ;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.
;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.