题目内容
【题目】Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
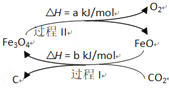
整个过程中Fe3O4的作用是________________________________。
(2)已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
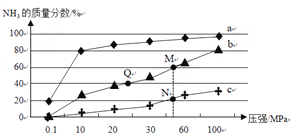
①下列说法正确的是__________。(填字母)
a.曲线a、b、c对应的温度是由低到高
b.加入催化剂能加快化学反应速率和提高H2的转化率
c.图中Q、M、N点的平衡常数:K(N)>K(Q)=K(M)
②M点对应H2的转化率是__________。
③2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
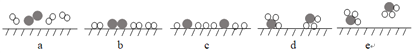
![]() 、
、![]() 和
和![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是____________和______________。
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是____________和______________。
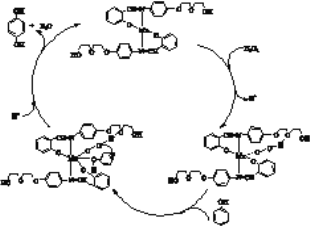
(3)有机反应中也常用到催化剂。某反应原理可以用下图表示,写出此反应的化学方程式_____________________________。
Ⅱ.过二硫酸钾(K2S2O8)在科研与工业上有重要用途。
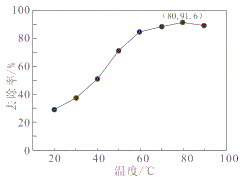
(4)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理燃煤锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。一定条件下,NO去除率随温度变化的关系如图所示。80℃时,若NO初始浓度为450 mg·m-3,t min达到最大去除率,NO去除的平均反应速率:v(NO)=__________mol·L-1·Min-1(列代数式,不必计算结果)
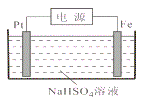
(5)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如图所示。
常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
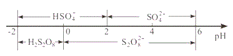
在阳极放电的离子主要是HSO4,阳极区电解质溶液的pH范围为___________,阳极的电极反应式为_____________。
【答案】 中间产物 a 60% N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2分子中化学键断裂 ![]() + H2O2
+ H2O2![]()
![]() + H2O
+ H2O ![]() (或
(或![]() 或
或![]() ) 0~2 2HSO4--2e-=S2O42-+2H+
) 0~2 2HSO4--2e-=S2O42-+2H+
【解析】Ⅰ.(1)将CO2转化为炭黑进行回收利用,根据反应过程I、II,整个过程中Fe3O4的是一个中间产物,故其作用是中间产物;
(2)①该反应为放热反应,压强相同时,升高温度,平衡逆向移动,氨气质量分数减小,故曲线a、b、c对应的温度是由低到高,故a正确;b.加入催化剂能加快化学反应速率但不能影响平衡移动不会提高H2的转化率,故b错误;c.图中Q、M温度相同,K(Q)=K(M),N点比M点温度高,平衡逆向移动,平衡常数减小,故K(N)<K(Q)=K(M),故c错误;故选a;
②M点时,氨气的转化率是60%, n(N2)∶n(H2) = 1∶3,设n(N2)=1mol,n(H2)=3mol 气体总质量为34g
故平衡时n(NH3)=1.2mol
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
转化(mol) 0.6 1.8 1.2
平衡(mol) 0.4 1.2 1.2
H2的转化率:![]() ×100%=60%;
×100%=60%;
③根据图示![]() 、
、![]() 和
和![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是
N2、H2被吸附在催化剂表面 、在催化剂表面,N2、H2分子中化学键断裂;
(3)由图示可知:反应物为![]() 和H2O2,生成物是
和H2O2,生成物是![]() 和H2O ,故方程式为:
和H2O ,故方程式为:![]() + H2O2
+ H2O2![]()
![]() + H2O ;
+ H2O ;
(4) NO初始浓度为450 mg·m-3,物质的量浓度是1.5×10-5mol/L,80℃时,t min达到最大去除率为91.6%,NO去除的平均反应速率:v(NO)=![]() =
=![]() mol·L-1·min-1;
mol·L-1·min-1;
(5) 在阳极放电的离子主要是HSO4-,根据阳极区含硫微粒的主要存在形式与pH的关系,电解质溶液的pH范围为0~2,阳极失电子,故HSO4-失电子生成S2O42-,故其电极反应为:2HSO4--2e-=S2O42-+2H+。