��Ŀ����
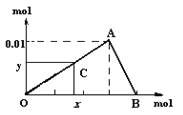
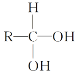
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH4+��Fe2+��Fe3+��CO32-��SO42-��SiO32-��NO3-�е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬ת����ϵ��ͼ��ʾ����Ӧ��������һ�������ڿ����л��Ϊ����ɫ���ش��������⣺

��1���������Ϣ��֪����ҺX��ȷ�������ڵ���������___��
��2������A��__(�ѧʽ)����������A�����ӷ���ʽΪ__��
��3��������з�����Ӧ�����ӷ���ʽΪ___��
��4�����������Ϣ��ͼ��ת����ϵ������ȷ����ҺX�п϶����ڵ�������__�����ܴ��ڵ�������__��������ܴ��ڵ������Ƿ���ڵķ�����__��
���𰸡�CO32-��SiO32-��NO3- NO 3Fe2++4H++NO3-=3Fe3++NO��+2H2O AlO2-+CO2+2H2O=Al(OH)3��+HCO3- Al3+��NH4+��SO42-��Fe2+ Fe3+ ȡ������ҺX���Թ��У��μӼ���KSCN��Һ������Һ���ɫ������ҺX�к���Fe3+������Һ�����ɫ������ҺX�в�����Fe3+
��������
��ǿ������Һ�У�CO32-��SiO32-���ܴ������ڣ�����Ba(NO3)2���ɳ���C������ҺX��һ������SO42-��X��һ��������Ba2+����������A���������ΪNO��ԭ��Һ��һ��������NO3-���������NaOH��Һ������������ΪNH3����X��һ������NH4+���������NaOH��Һ����������E���Ҵ˳����������ᣬ��X��һ������Fe2+�����ܺ���Fe3+����ҺF��ͨ�������CO2�����ɳ���H����X��һ������Al3+��
��1���������Ϣ�ķ�������ȷ����ҺX�в����ڵ������ӡ�
��2������A��NO����������NO��ԭ����Fe2+��������Һ����NO3-�����˷�Ӧ��
��3���������AlO2-�����CO2��ˮ��Һ�з�����Ӧ��
��4�����������Ϣ��ͼ��ת����ϵ������ȷ����ҺX�п϶����ڵ�����ΪAl3+��NH4+��SO42-��Fe2+�����ܴ��ڵ�������Fe3+��������ܴ��ڵ������Ƿ���ڣ���ʹ��KSCN��Һ��
��ǿ������Һ�У�CO32-��SiO32-���ܴ������ڣ�����Ba(NO3)2���ɳ���C������ҺX��һ������SO42-��X��һ��������Ba2+����������A���������ΪNO��ԭ��Һ��һ��������NO3-���������NaOH��Һ������������ΪNH3����X��һ������NH4+���������NaOH��Һ����������E���Ҵ˳����������ᣬ��X��һ������Fe2+�����ܺ���Fe3+����ҺF��ͨ�������CO2�����ɳ���H����X��һ������Al3+��
��1���������Ϣ�ķ�������ȷ����ҺX�в����ڵ�������ΪCO32-��SiO32-��NO3-����Ϊ��CO32-��SiO32-��NO3-��
��2������A��NO����������NO������Fe2+��������Һ����NO3-�����˷�Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3-=3Fe3++NO��+2H2O����Ϊ��NO��3Fe2++4H++NO3-=3Fe3++NO��
+2H2O��
��3���������AlO2-�����CO2��ˮ��Һ�з�����Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O
=Al(OH)3��+HCO3-������AlO2-+CO2+2H2O=Al(OH)3��+HCO3-��
��4�����������Ϣ��ͼ��ת����ϵ������ȷ����ҺX�п϶����ڵ�����ΪAl3+��NH4+��SO42-��Fe2+�����ܴ��ڵ�������Fe3+��������ܴ��ڵ������Ƿ���ڵķ�����ȡ������ҺX���Թ��У��μӼ���KSCN��Һ������Һ���ɫ������ҺX�к���Fe3+������Һ�����ɫ������ҺX�в�����Fe3+����Ϊ��Al3+��NH4+��SO42-��Fe2+��Fe3+��ȡ������ҺX���Թ��У��μӼ���KSCN��Һ������Һ���ɫ������ҺX�к���Fe3+������Һ�����ɫ������ҺX�в�����Fe3+��

����Ŀ������������Ű�����ཡ������������Ӱ�죮ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO![]() 2CO2��g��+N2��g����H��0
2CO2��g��+N2��g����H��0
�ٷ�Ӧ������-ʱ��ͼ����ͼ����ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ����ʾ������˵����ȷ����___________�����Ӧ��ĸ����
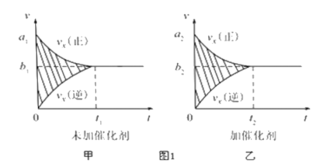
A�� a1��a2 B��b1��b2 C��t1��t2 D��ͼ������Ӱ�����������E��ͼ������Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�

��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g��![]() N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
2NO2��g��![]() N2O4��g����H=��56.9kJ/mol
N2O4��g����H=��56.9kJ/mol
H2O��g��=H2O��l����H=��44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��______________��
��3��CH4��H2O��g���ڴ������淢����ӦCH4+H2OCO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������
�¶�/�� | 800 | 1000 | 1200 | 1400 |
ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
�ٸ÷�Ӧ��_________��Ӧ��������������������������
��T��ʱ����1L�ܱ�������Ͷ��lmolCH4��lmolH2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O![]() CO+3H2��ƽ�ⳣ��K=______________��
CO+3H2��ƽ�ⳣ��K=______________��
����Ŀ���Ҵ�����Ҫ�Ļ���ԭ�ϣ�Ҳ��������Դ��
��ҵ�ϣ���һ������������ϩˮ�����Ʊ��Ҵ�����֪�Ȼ�ѧ����ʽ���£�
��CH2=CH2(g)+H2O(g)CH3CH2OH(g) ��H1
��2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ��H2
��2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ��H3
��1�����ֻ�ѧ���ļ������£�
��ѧ�� | H-C | C=C | H-O | C-O | C-C |
����kJ��mol-1 | 413 | 615 | 463 | 351 | 348 |
���ݼ��ܼ��㦤H1=________________kJ��mol-1��
��2���ں����ܱ������з�����Ӧ�ڣ�������˵���÷�Ӧ�ﵽƽ�����_________��
a����������ѹǿ���ֲ���
b��H2O(g)������������CH3CH2OCH2CH3(g)�����������
c������ƽ��Ħ���������ֲ���
d�������������ܶȱ��ֲ���
��3�����ܱ�������Ͷ��CH2=CH2(g)��H2O(g)�ʹ���������Ӧ�٣���ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

��x����________________����ѡ��¶ȡ���ѹǿ����
��L1��L2�ĸ�����˵�����ɣ�_____________________________________________________��
����ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2molA��1molB�����г���2molC��lmolHe����ʱKͣ��0������һ�������·������淴Ӧ��2A(g)+B(g)2C(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȡ��ش��������⣺

��4���ﵽƽ��ʱ������K����ͣ����0�̶����ijһ������Ϊa������a��ȡֵ��Χ��__________��
��5�����ﵽƽ��ʱ������K����ͣ�������̶�1������ʱ���ݻ�Ϊ2L����÷�Ӧ��ѧƽ�ⳣ��Ϊ_______________��
��6����һ��ʼ�ͽ�K��F����ͼ�̶����������������䣬��ﵽƽ��ʱ����ü���A��ת����Ϊb��������C��ת����Ϊ____________��