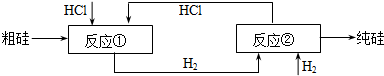
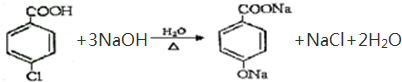
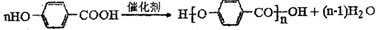题目内容
如图所示,①②③④分别是几种常用漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).
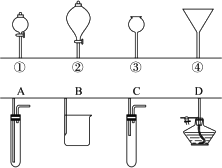
请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中的哪一种最为匹配.
A与________;B与________;C与________;D与________.
答案:
解析:
解析:
|
答案:③ ② ① ④ 解析:A、C选项为气体的发生装置,A选项安装的是长颈漏斗,C选项安装的是分液漏斗,故A选项与③相连,C选项与①相连;D选项表示向酒精灯加酒精的操作,故应与④相连. |

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
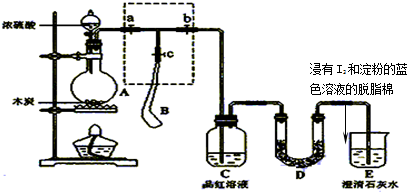
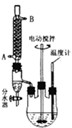 (2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
(2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下: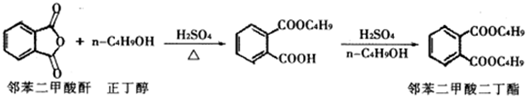

 乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是
乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是