题目内容
7.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
分析 A.溶液中存在含氯微粒有Cl2、ClO-、Cl-、HClO,氯气分子是主要存在的含氯微粒;
B.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.溶液中存在电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),混合溶液呈中性,则c(OH-)=c(H+),所以c(Na+)+c(NH4+)=2c(SO42-),二者反应生成硫酸钠、硫酸铵,要使溶液呈中性,二者的物质的量应该稍微小于1:1,且铵根离子还水解,据此判断离子浓度大小.
解答 解:A.溶液中存在含氯微粒有Cl2、ClO-、Cl-、HClO,氯气分子是主要存在的含氯微粒,已经反应的氯气存在物料守恒c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO),但溶液中不存在c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO),故A错误;
B.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HClO)+c(ClO-)=(CO32-)+c(HCO3-)+c(H2CO3)=$\frac{1}{2}$c(Na+),故C错误;
D.溶液中存在电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),混合溶液呈中性,则c(OH-)=c(H+),所以c(Na+)+c(NH4+)=2c(SO42-),二者反应生成硫酸钠、硫酸铵,要使溶液呈中性,二者的物质的量应该稍微小于1:1,且铵根离子还水解,水解程度较小,所以溶液中离子浓度大小顺序是(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选BD.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意守恒思想的应用,易错选项是AD,注意D中二者物质的量相对大小是解D选项关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
| A. | 原子半径:r(X)>r(Y)>r(Z)>r(W) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Y的最高价氧化物对应的水化物碱性比Z的强 |
| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物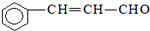 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 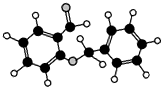 如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
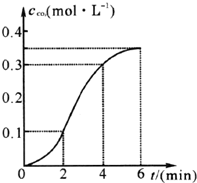 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
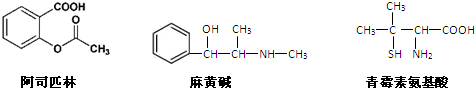
| A. | 青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 | |
| B. | 阿司匹林能与NaOH溶液反应生成可溶性有机物 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 | |
| D. | 三种有机物都能发生酯化反应 |
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: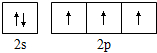 | ||
| C. | CO2的比例模型: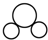 | D. | Cl-的结构示意图: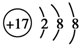 |
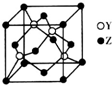 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题: