题目内容
【题目】以![]() 、NaOH、
、NaOH、![]() 尿素
尿素![]() 和
和![]() 为原料可制备
为原料可制备![]() 水合肼
水合肼![]() 和无水
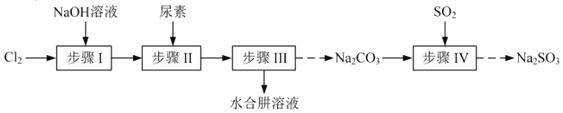
和无水![]() ,其主要实验流程如下:
,其主要实验流程如下:
已知:①![]() 是放热反应。
是放热反应。
②![]() 沸点约
沸点约![]() ,具有强还原性,能与 NaClO剧烈反应生成
,具有强还原性,能与 NaClO剧烈反应生成![]() 。
。
(1)步骤I制备NaClO溶液时,若温度超过![]() ,
,![]() 与NaOH溶液反应生成
与NaOH溶液反应生成 ![]() 和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
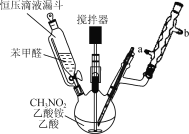
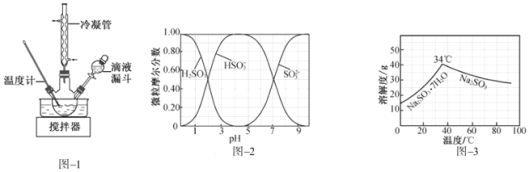
(2)步骤Ⅱ合成![]() 的装置如图
的装置如图![]() 所示。 NaClO碱性溶液与尿素水溶液在
所示。 NaClO碱性溶液与尿素水溶液在![]() 以下反应一段时间后,再迅速升温至
以下反应一段时间后,再迅速升温至![]() 继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品![]() 制备无水
制备无水![]() 水溶液中
水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图
随pH的分布如图![]() 所示,
所示,![]() 的溶解度曲线如图
的溶解度曲线如图![]() 所示
所示![]() 。
。
①边搅拌边向![]() 溶液中通入
溶液中通入![]() 制备
制备 ![]() 溶液。实验中确定何时停止通
溶液。实验中确定何时停止通![]() 的实验操作为______。
的实验操作为______。
②请补充完整由 ![]() 溶液制备无水
溶液制备无水![]() 的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
【答案】![]() 缓慢通入氯气 NaClO碱性溶液 减少水合肼的挥发 测量溶液的pH,若pH约为4,停止通
缓慢通入氯气 NaClO碱性溶液 减少水合肼的挥发 测量溶液的pH,若pH约为4,停止通![]() 边搅拌边向
边搅拌边向![]() 溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于![]() 条件下趁热过滤
条件下趁热过滤
【解析】
由实验流程可知步骤Ⅰ为氯气和氢氧化钠溶液的反应,生成NaClO,为避免生成NaClO3,应控制温度在40℃以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息解答该题。
(1)温度超过40℃,Cl2与NaOH溶液反应生成 NaClO3和NaC1,反应的离子方程式为![]() ,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高;故答案为:
,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高;故答案为:![]() ;缓慢通入氯气;
;缓慢通入氯气;
(2)实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液,避免N2H4H2O与NaClO剧烈反应生成N2,为避免N2H4H2O的挥发,可使用冷凝管回流;故答案为:NaClO碱性溶液;减少水合肼的挥发;
(3)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3,
①由图象可知,如溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,可通过测量溶液pH的方法控制;故答案为:测量溶液的pH,若pH约为4,停止通SO2;
②由NaHSO3溶液制备无水Na2SO3,可边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,由图象可知pH约为10时,可完全反应生成Na2SO3,此时停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,由图象3可知在高于34℃条件下趁热过滤,可得到无水Na2SO3;故答案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案