题目内容
20℃时,氢硫酸的浓度为0.1mol/L,其电离方程式为H2S H++HS-,HS-
H++HS-,HS- H++S2-,若要使该溶液的pH增大的同时c(S2-)减小,可采用的措施是
H++S2-,若要使该溶液的pH增大的同时c(S2-)减小,可采用的措施是
[ ]
A.加入适量的水
B.加入适量的NaOH固体
C.通入适量的SO2
D.加入适量的CuSO4固体
答案:AC
解析:
解析:
|
导解:加水后粒子的浓度减小,所以c(H+)和c(S2-)都减少,pH增大.通入适量的SO2后,发生反应2H2S+SO2=3S↓+2H2O,c(H2S)减小,平衡向左移动,所以c(H+)和c(S2-)都减少,pH增大. |

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
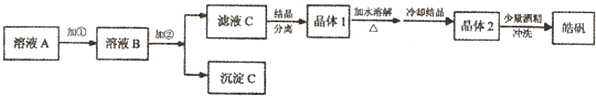
用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取皓矾(ZnSO4?7H2O),并探究其性质.
(l)制备皓矾 实验流程如下图所示:

已知:氢氧化物沉淀的pH范围见下表.
请回答下列问题:
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 .
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 .
③从晶体l→晶体2,该过程的名称是 .
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 .
(2)探究皓矾的性质
⑤称取28.7g ZnSO4?7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见上表.则1000℃时皓矾的反应方程式为 .
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为: .
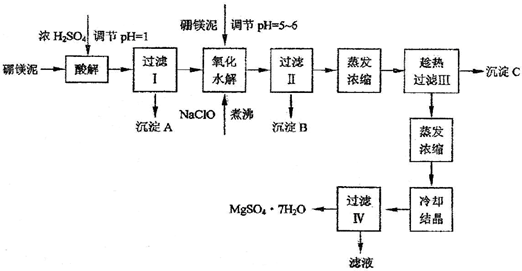
(l)制备皓矾 实验流程如下图所示:

已知:氢氧化物沉淀的pH范围见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 |
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
③从晶体l→晶体2,该过程的名称是
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(2)探究皓矾的性质
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为:

 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.