题目内容
(18分)下表为长式周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出元素D与A形成的化合物的电子式 ,该化合物分子的空间构型是 ,其中元素D的杂化方式为 。
(2)J的离子结构示意图 ;K元素在周期表的位置 。元素L基态原子的电子排布式 。
(3)E、H、I 这三种元素的第一电离能由大到小的顺序是(填对应的元素符号) ;
(4)由D、J的氢化物相互作用所生成的物质所含化学键有下列的 。
A、离子键
B、非极性键
C、极性键
D、金属键
E、配位键
(5)用氢键表示式写出F的氢化物水溶液中所有氢键
(1)电子式略 (2分) 三角锥型(2分)。sp3 (1分) (2)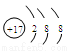 (1分)
(1分)
第四周期第Ⅷ族 ;(2分)[Ar]3d104s1; (2分)(3)O>Mg> Al(2分)(4)ACE(2分)(5)F—H...F 、 F—H...O 、 O—H...F 、 O—H...O (4分)
【解析】
试题分析:(1)从表中知道A是H,D是N ,形成化合物电子式为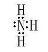
氨分子的空间结构是三角锥形,N 轨道中p的3个电子与3个H进行杂化,杂化方式为sp3
(2)J为Cl,那么离子结构示意图为: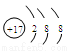 周期表第四周期从左到右族序数依次是ⅠA、ⅡA
周期表第四周期从左到右族序数依次是ⅠA、ⅡA
、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB…… 所 以K是在第Ⅷ族,L是29号元素基态原子的电子排布式可写成[Ar]3d104s1(3)E、H、I分别为O、Mg、Al,元素金属性越强第一电离能越小,所以第一电离能大小为: O>Mg> Al(4)由D、J的氢化物相互作用所生成的物质是NH4Cl,是离子化合物则有离子键,N和H可形成极性键和配位键,所以化学键种类为离子键、极性键、配位键。
(5)F的氢化物则是HF,水溶液中氢键有F—H...F 、 F—H...O 、 O—H...F 、 O—H...O
考点:元素周期表的结构、原子、离子结构示意图的书写、电离能大小比较以及化学键的类型。

a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:由上述现象可推知a、b、c、d依次是
反应物 | a+b | c+d | a+d | a+c | b+d |
现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
A.HCl、BaCl2、AgNO3、Na2CO3
B.AgNO3、HCl、BaCl2、Na2CO3
C.AgNO3、HCl、Na2CO3、BaCl2
D.BaCl2、Na2CO3、 AgNO3、HCl
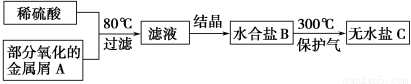
 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是