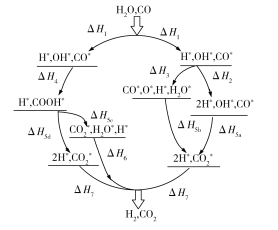
题目内容
【题目】碳酸钾主要用作食品膨松剂,也用于彩色电视机工业。
(1)K2CO3溶液呈________(填“酸”或“碱”)性,其原因是_________(用离子方程式表示);请设计一个简单的实验方案证明上述观点:__________。
(2)下列有关0.1 mol·L-1的K2CO3溶液的叙述错误的是________(填标号)。
A.c(K+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(3)室温下将0.1 mol·L-1的K2CO3溶液与0.1 mol·L-1的盐酸等体积混合,所得溶液中各离子的浓度由大到小的顺序为_________________。
(4)将CO2通入0.1 mol·L-1的K2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=_________mol·L-1(忽略溶液体积变化)。
【答案】碱 CO32-+H2O![]() HCO3-+OH- 向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失 AC c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) >c(CO32-) 0.2
HCO3-+OH- 向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失 AC c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) >c(CO32-) 0.2
【解析】
(1)K2CO3为强碱弱酸盐,其水溶液会发生水解反应,证明其水解的事实时,一方面要证明水解产物的存在,另一方面要证明反应的可逆性。
(2)A.c(K+)=2c(CO32-),利用化学式与水解进行分析;
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),利用水解方程式进行分析;
C.c(CO32-)+c(HCO3-)=0.1 mol·L-1,利用物料守恒进行分析;
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),利用质子守恒进行分析。
(3)室温下将0.1 mol·L-1的K2CO3溶液与0.1 mol·L-1的盐酸等体积混合,所得溶液中溶质为KHCO3和KCl,利用电离与水解方程式及难易程度进行分析。
(4)将CO2通入0.1 mol·L-1的K2CO3溶液中至溶液呈中性,则利用电荷守恒原理计算溶液中2c(CO32-)+c(HCO3-)。
(1)K2CO3为强碱弱酸盐,其水溶液会发生水解反应而使溶液呈碱性,其原因是CO32-+H2O![]() HCO3-+OH-;设计实验方案时,可测定溶液中存在OH-(显碱性)、可逆性,平衡会发生移动,于是设计方案为:向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失。答案为:碱;CO32-+H2O
HCO3-+OH-;设计实验方案时,可测定溶液中存在OH-(显碱性)、可逆性,平衡会发生移动,于是设计方案为:向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失。答案为:碱;CO32-+H2O![]() HCO3-+OH-;向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失;
HCO3-+OH-;向纯碱溶液中滴加几滴酚酞试液后,溶液呈红色,然后滴加氯化钙溶液至过量,溶液红色逐渐变浅,最后消失;
(2) A.起初K2CO3发生电离,c(K+)=2c(CO32-),在水溶液中CO32-发生水解,所以最后溶液中c(K+)>2c(CO32-),A错误;
B.K2CO3溶液中存在如下平衡:CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-、H2O
H2CO3+OH-、H2O![]() H++OH-,且程度依次减弱,所以c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),B正确;
H++OH-,且程度依次减弱,所以c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),B正确;
C.利用物料守恒,K2CO3溶液中,c(CO32-)+c(HCO3-)+c(H2CO3)=0.1 mol·L-1,则c(CO32-)+c(HCO3-)<0.1 mol·L-1,C错误;
D.利用质子守恒,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),D正确;
由以上分析可知,AC错误,故答案为AC;
(3)室温下将0.1 mol·L-1的K2CO3溶液与0.1 mol·L-1的盐酸等体积混合,所得溶液中溶质为KHCO3和KCl,溶液中HCO3-以水解为主,电离为次,则各离子的浓度由大到小的顺序为c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) >c(CO32-)。答案为:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) >c(CO32-);
(4)将CO2通入0.1 mol·L-1的K2CO3溶液中至溶液呈中性,则利用电荷守恒原理,溶液中2c(CO32-)+c(HCO3-)=c(K+)=2×0.1 mol·L-1=0.2mol·L-1。答案为:0.2。