��Ŀ����
����Ŀ�����ڵؿ��еĺ������࣬��Ҫ��������þ����ɰ�ȸ������С��ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ_______����Ԫ�ص�ij��ͬ��������B12���۵�λ2180�棬�ݴ��Ʋ�B12�����ۻ�ʱ�ƻ���������Ϊ__________��
��2��������ͬ����������Ԫ�صĵ�һ�������ɴ�С��˳����__________��
��3����ԭ�������ֻ���������ӣ�����縺�Խϴ�ԭ����_________��
��4��������(H3BO3)�ǰ�ɫ���壬�侧����������ζԳ�Ƭ״����ṹ����ͼ��ʾ��
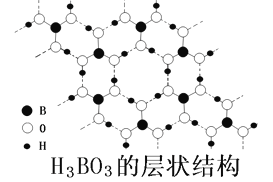
������������е�Bԭ�Ӳ�ȡ__________�ӻ���1molH3BO3ƽ���γ�________mol�����
����������۵�ԶԶ�����������[B(OCH3)3]��ԭ����________��
��5��д����BF3��Ϊ�ȵ������2��������_________���ѧʽ����
��6����ͼΪ�����������ṹʾ��ͼ������Nԭ�ӵ���λ��Ϊ____����Nԭ�Ӱ뾶Ϊa pm��Bԭ�Ӱ뾶Ϊb pm������٤������ֵΪNA������������������ܶ�Ϊ________g/cm3����ʽ���ɣ���

���𰸡� 1s22s22p1 ���ۼ����Ǽ��Լ��������Ǽ��Թ��ۼ����������»��� C>Be>B B��ԭ�Ӱ뾶��С����������˵����ɣ� sp2 3 ��������Ӽ����γɷ��Ӽ�����������۵�ϸ� NO3-��CO32-��SiO32-��BO33-�� 4 
����������1����̬��ԭ�ӵĺ����������5����������Ų�ʽΪ1s22s22p1����Ԫ�ص�ij��ͬ��������B12���۵�Ϊ2180�棬�۵�ߣ��ݴ��Ʋ�B12�����ۻ�ʱ�ƻ���������Ϊ���ۼ�����2��ͬ�����������ҵ�һ������������Be��2s�������ȫ����״̬�ȶ���ǿ����������ͬ����������Ԫ�صĵ�һ�������ɴ�С��˳����C>Be>B����3����ԭ�������ֻ���������ӣ���B��ԭ�Ӱ뾶��С�������縺�Խϴ�4����Bֻ�γ���3��������û�йµ��Ӷԣ����Բ�ȡsp2�ӻ���1����������γ���6���������ÿ�������2��������ӹ��õģ�����ƽ����3���������1molH3BO3ƽ���γ�3mol�������������������Ӽ����γɷ��Ӽ�����������۵�ϸߡ���5��ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬����BF3��Ϊ�ȵ������������NO3-��CO32-��SiO32-��BO33-�ȡ���6�����ݾ����ṹ���ж�Nԭ�ӵ���λ��Ϊ4����Nԭ�Ӱ뾶Ϊa pm��Bԭ�Ӱ뾶Ϊb pm�������������Խ�����4(a+b)pm=4(a+b)��10��10cm���߳���![]() ��������Nԭ����ĿΪ4��Bԭ����ĿΪ8��1/8+6��1/2=4����������Ϊ4��25/NAg�����Ծ����ܶ�=
��������Nԭ����ĿΪ4��Bԭ����ĿΪ8��1/8+6��1/2=4����������Ϊ4��25/NAg�����Ծ����ܶ�=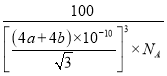 g/cm3��
g/cm3��