题目内容
(1)写出下列微粒的原子(离子)结构示意图
Mg ;Cl- 。
(2)12.4 g Na2R中含0.4 mol Na+,则12.4 g Na2R的物质的量为 mol,摩尔质量为 。
(3)选择下列合适的实验方法分离物质。
A加热分解 B结晶法 C分液法 D蒸馏法 E过滤法
① 分离水和汽油的混合物 ;② 除去氧化钙中的碳酸钙 。
(4)①高锰酸钾和浓盐酸可以发生如下反应:
2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O,在该反应中,氧化剂是__________。
②标出上述方程式电子转移的方向与数目(用双线桥法)。
中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是 (填字母)。
(2)下列操作合理的是 (填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaOH溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
Ⅱ. 某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是 ___(填编号)。
(2)判断滴定终点的现象是: 。
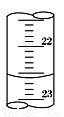
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据,请计算待测盐酸的浓度: mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 (填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液


 H2(g)+I2(g)。若c(HI)由1.0 mol/L降低到0.7 mol/L时,需要15 s,那么c(HI)由0.7 mol/L降到 0.5 mol/L时,所需反应的时间为( )
H2(g)+I2(g)。若c(HI)由1.0 mol/L降低到0.7 mol/L时,需要15 s,那么c(HI)由0.7 mol/L降到 0.5 mol/L时,所需反应的时间为( ) 2H++S2-
2H++S2- A.某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32-
A.某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32-