题目内容
对于反应3Cl2+6NaOH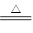 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
C
解析试题分析:A项在该反应属于岐化反应,Cl2既是氧化剂,又是还原剂,错误;B项由于没有告诉气体的标准状况下,无法计算,错误;D项被氧化的氯原子和被还原的氯原子的物质的量之比应该为1∶5,错误。
考点:考查氧化还原的概念、计算等。

练习册系列答案
相关题目
对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
| A.该反应既属于四种基本类型的反应,又属于氧化还原反应 |
| B.氧元素被还原,硫元素被氧化 |
| C.每有3 mol S参加反应转移6 mol电子 |
| D.S既是氧化剂又是还原剂 |
向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
| A.0.24 mol | B.0.21 mol | C.0.16 mol | D.0.14 mol |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转化为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度,Ksp(ZnS)<Ksp(CuS) |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
在炼铜的过程中发生:Cu2S + 2Cu2O =" 6Cu" + SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
下列反应或过程一定不是氧化还原反应的是( )
| A.ΔH<0 的反应 | B.古人用热分解法制水银 |
| C.用明矾净水 | D.实验室用浓盐酸和MnO2制Cl2 |
下列离子中,只有还原性的是
| A.Na+ | B.Fe2+ | C.Br— | D.SO32— |
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = = |
| B.参加反应的氯气的物质的量等于0.5amol |
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol≤ne≤ amol amol |
D.改变温度,产物中KC1O3的最大理论产量为 amol amol |