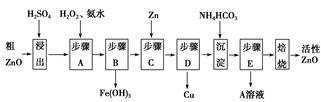
题目内容
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
下列说法错误的是
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
B
试题分析:pH=4,则c(OH?)=10-10mol?L?1,带入Ksp公式可求得Fe3+浓度,c(Fe3+)=4.0×10-8 mol?L?1, e3+全部转化为Fe(OH)3沉淀,假设也能生成Fe(OH)2沉淀,达到沉淀溶解平衡时,c(Fe2+)=8.0×104mol?L?1,实际Fe2+浓度小于8.0×104mol?L?1,所以沉淀中没有Fe(OH)2,只有Fe(OH)3,故B项错误。sp应用。

练习册系列答案
相关题目

 AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816