题目内容
下列离子方程式正确的是( )
| A、碳酸氢钠溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
| B、硫化亚铁与盐酸反应:S2?+2H+=H2S↑ |
| C、三氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+ |
| D、氯化亚铁溶液中通入少量氯气:Fe2++Cl2=Fe3++2Cl? |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢根离子在离子反应中不能拆分;
B.FeS在离子反应中保留化学式;
C.反应生成氯化铜、氯化亚铁;
D.反应生成氯化铁.
B.FeS在离子反应中保留化学式;
C.反应生成氯化铜、氯化亚铁;
D.反应生成氯化铁.
解答:
解:A.碳酸氢钠溶液中加入盐酸的离子反应为HCO3-+H+=CO2↑+H2O,故A错误;
B.硫化亚铁与盐酸反应的离子反应为FeS+2H+=Fe2++H2S↑,故B错误;
C.三氯化铁溶液与铜反应的离子反应为2Fe3++Cu=2Fe2++Cu2+,故C正确;
D.氯化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选C.
B.硫化亚铁与盐酸反应的离子反应为FeS+2H+=Fe2++H2S↑,故B错误;
C.三氯化铁溶液与铜反应的离子反应为2Fe3++Cu=2Fe2++Cu2+,故C正确;
D.氯化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选C.
点评:本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写反应为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意选项CD最高电子、电荷守恒分析,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
在电解水的实验中需要加少量电解质来增强水的导电性.下列属于电解质,且加入水中能增强导电性的是( )
| A、铜 |
| B、NaOH |
| C、H2SO4溶液 |
| D、BaSO4 |
下列变化中不可能通过一步反应完成的是( )
| A、Al→Al(OH)3 |
| B、Al2O3→NaAlO2 |
| C、Fe→Fe3O4 |
| D、Fe(OH)2→Fe(OH)3 |
下列各组物质既可用酸性KMnO4溶液,又可用溴水鉴别的是( )
| A、苯、甲苯 |
| B、戊烯、二甲苯 |
| C、苯、KI溶液 |
| D、乙烷、乙烯 |
溴化碘(IBr)的化学性质与卤素单质相似,能与许多金属反应生成卤化物,能与许多非金属单质反应生成卤化物,能与水反应且方程式为IBr+H2O=HBr+HIO.下列叙述不正确的是( )
| A、IBr是一种有色物质 |
| B、在IBr与水的反应中,它既是氧化剂又是还原剂 |
| C、在许多反应中IBr是强氧化剂 |
| D、IBr与NaOH溶液反应生成NaBr和NaIO |
下列情况下,气体分子数相同的是( )
| A、相同体积的CO和CO2 |
| B、相同物质的量的H2O(g)和Cl2 |
| C、在0℃时,1体积的O2和1体积的HCl |
| D、通常状况下71克Cl2和22.4LHCl气体 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、pH=7的溶液:Al3+、K+、SO
| ||||
B、能使淀粉碘化钾试纸显蓝色的溶液中:K+、Na+、S2-、SO
| ||||
| C、由水电离出c(OH-)=1×10-12mol?L-1的溶液:K+、HCO3-、Na+、Cl- | ||||
D、滴入KSCN溶液后显红色的溶液:Na+、Cu2+、Br-、SO
|
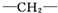 ,一个
,一个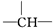 ,则X的结构简式为
,则X的结构简式为