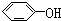
题目内容
20.某化学课外学习小组对元素周期律和元素周期表进行研究和探讨,一部分同学提出了下列看法,你认为不正确的是( )| A. | 原子的最外层有两个电子的元素并不都在第ⅡA族 | |
| B. | 第ⅠA族元素都是典型的金属元素 | |
| C. | 第ⅦA族的元素最外层都有七个电子 | |
| D. | 第三周期的元素的原子核外都有三个电子层 |
分析 A、氦原子核外有2个电子处于零族,一般性质相似处于同一族.
B、第ⅠA族元素除碱金属外还包括氢元素.
C、主族元素最外层电子数等于族序数.
D、原子的电子层数等于周期数(钯除外).
解答 解:A、氦原子核外有2个电子,处于零族,故A错误;
B、第ⅠA族元素除碱金属外还包括氢元素,故B错误;
C、第ⅦA族的元素的原子最外层都有七个电子,故C错误;
D、电子层数等于周期数,所以第三周期的元素的原子核外都有三个电子层,故D正确.
故选:D.
点评 考查元素周期表的结构、原子结构与位置关系,难度不大,注意周期表中的一些特殊性.

练习册系列答案
相关题目
10.在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.2mol•L-1、0.1mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
11.漂白粉可由Cl2通入消石灰中制备,漂白粉的有效成分是( )
| A. | Ca(OH)2 | B. | CaCl2 | C. | Ca(ClO)2 | D. | CaCO3 |
8.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、Cl-、Ca2+、Na+ | D. | Fe2+、Na+、Cl-、NO3- |
15.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含电子数目为7NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 1mol苯乙烯(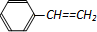 )中含有的C=C数为4NA )中含有的C=C数为4NA |
5.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:X>Y>Z |
9.下列有关阿佛加德罗常数(NA)的说法正确的有( )
| A. | 标准状况下,22.4L SO3所含的分子数目为NA | |
| B. | 0.2molH2O2催化分解,转移电子数为0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03NA | |
| D. | 6.25 mL1 mol/L浓硫酸与足量铜反应,转移电子数为0.2NA |
 与
与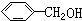
 与
与