��Ŀ����
��14�֣�ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���塣
��1������Ԫ��Y ��ԭ�ӽṹʾ��ͼ
��2��X��W��ɵĻ������д��� ��������ӡ������ۡ�����
��3����X��Y��Z��W����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ�����ӷ���ʽΪ ��
��4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����A
����֪1mol A��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���塣д������������A��NaOH��Һ��Ӧ�����ӷ���ʽ ��
����֪A���������ᷴӦ����������ˮ��Ӧ��д��A����ˮ��Ӧ�����ӷ���ʽ
��
��5����X��Y��Z��W��Fe����Ԫ����ɵ�ʽ��Ϊ392�Ļ�����B��1 mol B�к���6mol�ᾧˮ���Ի�����B��������ʵ�飺
a ȡB����Һ�������ŨNaOH��Һ�����ȣ���ɫ�̼�����ζ����Ͱ�ɫ��������ɫ������Ϊ����ɫ�����ձ�Ϊ���ɫ��
b ��ȡB����Һ���������BaCl2��Һ������ɫ������������������ܽ�
B�Ļ�ѧʽΪ ��
�� ��֪1 mol��L��1 100mL B����Һ����1 mol��L��1 20mLKMnO4��Һ�������ữ��ǡ�÷�Ӧ��д����Ӧ�����ӷ���ʽ
��1��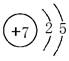 (2������
(2������
��3��3Cu + 2NO3�� + 8H+�� 3Cu2+ + 2NO�� + 4H2O
��4���� NH4+
+ OH�� 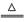 H2O + NH3��
H2O + NH3��
�� SO32�� + Cl2 + H2O �� SO42�� + 2Cl�� + 2H+
��5���� (NH4)2Fe (SO4)2��6H2O
�� 5Fe2+ + MnO4�� + 8H+ �� 5Fe3+ + Mn2+ + 4H2O
��������
���������XΪH����Zԭ������Ϊx����Y��Wԭ�������ֱ�Ϊx-1��x+8��������Ԫ��ԭ������֮��Ϊ32����x=8������Y��Z��W�ֱ�ΪN��O��S��
��1��N��ԭ������Ϊ7��ԭ�ӽṹʾ��ͼΪ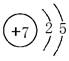 ��
��
��2�������������⣬���д��ڹ��ۼ���
��3��H��N��O��S�е�����Ԫ�����һ��ǿ�����Ϊ��������ᣬϡ������ͭ����Ӧ��ϡ�������ͭ��Ӧ�����ӷ���ʽΪ3Cu + 2NO3�� + 8H+�� 3Cu2+ + 2NO�� + 4H2O��
��4��H��N��O��S������ӻ��������Ϊ����炙�������炙�������炙���������泥���֪1mol A��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L�����֪AΪ����炙�������泥�����������A������������Һ��Ӧ�뷽��ʽΪNH4+ + OH��
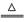 H2O + NH3�������������ᷴӦ��������ˮ��Ӧ����������泥������������ˮ��Ӧ���ӷ���ʽΪSO32�� + Cl2 + H2O
�� SO42�� + 2Cl�� + 2H+
��
H2O + NH3�������������ᷴӦ��������ˮ��Ӧ����������泥������������ˮ��Ӧ���ӷ���ʽΪSO32�� + Cl2 + H2O
�� SO42�� + 2Cl�� + 2H+
��
��5��B����Һ�����������������Һ�����ȣ�������ɫ�̼�������϶��ǰ�����˵��B�к�笠����ӣ���ɫ������Ϊ����ɫ������Ϊ���ɫ��˵��B�к��������ӡ�B����Һ�ӹ����Ȼ�����Һ������ɫ������������������ܽ�˵��B�к���������ӡ�B��ʽ��Ϊ392��1 mol B�к���6mol�ᾧˮ�����Ͽ�֪BΪ(NH4)2Fe (SO4)2��6H2O��
����������ʵ���Ϊ0.02mol��MnԪ�ص�0.02��5mol=0.1mole-��Fe2+���ʵ���Ϊ0.1mol������Fe2+��ȫ������ΪFe3+�����ӷ���ʽΪ5Fe2+ + MnO4�� + 8H+ �� 5Fe3+ + Mn2+ + 4H2O��
���㣺 Ԫ���ƶ� ��ѧ���� ���ӷ���ʽ
������ ����������ص㻹�ǿ���Ԫ�ػ�����֪ʶ��

 H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3-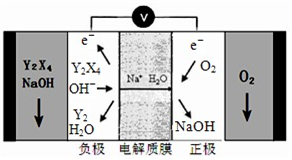
 X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����
X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����