题目内容
【题目】铝硅合金材料性能优良.铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如图1: 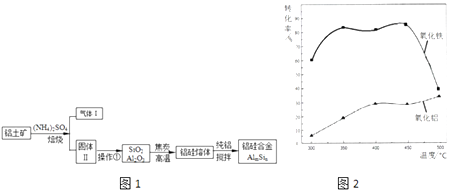
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性.原因是 .
(2)焙烧除铁反应时Fe2O3转化为NH4Fe(SO4)2 , Al2O3少部分发生类似反应,写出Fe2O3发生反应的方程式 . 氧化物转化为硫酸盐的百分率与温度的关系如图2,最适宜焙烧温度为 .
(3)若操作①中所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 .
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体.写出中间体SiC再与Al2O3反应生成铝、硅单质的化学方程式 .
(5)不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:n= .
【答案】
(1)铁与铝形成原电池,加快了铝的腐蚀
(2)4(NH4)2SO4+Fe2O3 ![]() 2NH4Fe(SO4)2+3H2O+6NH3↑;350℃
2NH4Fe(SO4)2+3H2O+6NH3↑;350℃
(3)Al3++4OH﹣=AlO2﹣+2H2O
(4)3SiC+Al2O3 ![]() 3Si+2Al+3CO↑
3Si+2Al+3CO↑
(5)9:5
【解析】解:(1)Al、Fe形成原电池,Al活泼性比Fe强的做负极,被腐蚀,所以铝硅合金材料中若含铁,容易发生电化学腐蚀;所以答案是:铁与铝形成原电池,加快了铝的腐蚀;(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2 , 所以 Fe2O3发生反应的方程式:4(NH4)2SO4+Fe2O3 ![]() 2NH4Fe(SO4)2+3H2O+6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率很低,所以最适宜焙烧温度为350℃;所以答案是:4(NH4)2SO4+Fe2O3
2NH4Fe(SO4)2+3H2O+6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率很低,所以最适宜焙烧温度为350℃;所以答案是:4(NH4)2SO4+Fe2O3 ![]() 2NH4Fe(SO4)2+3H2O+6NH3↑;350℃;(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH﹣=AlO2﹣+2H2O;
2NH4Fe(SO4)2+3H2O+6NH3↑;350℃;(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH﹣=AlO2﹣+2H2O;
所以答案是:Al3++4OH﹣=AlO2﹣+2H2O;(4)在高温条件下,SiC与Al2O3反应生成Al和CO,其反应的方程式为:3SiC+Al2O3 ![]() 3Si+2Al+3CO↑所以答案是:3SiC+Al2O3
3Si+2Al+3CO↑所以答案是:3SiC+Al2O3 ![]() 3Si+2Al+3CO↑;(5)投入1t铝土矿,加入27kg纯铝,已知铝土矿中含30% SiO2、40.8% Al2O3 , 则Al的总质量为:1000kg×40.8%×
3Si+2Al+3CO↑;(5)投入1t铝土矿,加入27kg纯铝,已知铝土矿中含30% SiO2、40.8% Al2O3 , 则Al的总质量为:1000kg×40.8%× ![]() +27kg=243kg,
+27kg=243kg,
Si的总质量为1000kg×30%× ![]() =140kg,则铝硅合金中m:n=
=140kg,则铝硅合金中m:n= ![]() :
: ![]() =9:5,
=9:5,
所以答案是:9:5.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案