题目内容
2.关于下列装置的叙述正确的是( ) |  |  |  |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |
分析 A、氯离子应在阳极放电,生成氯气,所以铜与负极相连;
B、锌比铁活泼,所以锌做负极,钢铁作正极,被保护;
C、食盐水的蒸发结晶在蒸发皿中进行;
D、二氧化锰与浓盐酸反应制取氯气需要加热,而生成的气体有毒不用排空气法.
解答 解:A、如果铜与正极相连,铜放电生成铜离子,氯离子应在阳极放电,生成氯气,所以铜与负极相连,故A错误;
B、锌比铁活泼,所以锌做负极,钢铁作正极,被保护,所以可用于潮汐能发电站钢阀门的保护,故B正确;
C、食盐水的蒸发结晶在蒸发皿中进行,而不在坩埚中进行,故C错误;
D、二氧化锰与浓盐酸反应制取氯气需要加热,而生成的气体有毒不用排空气法,而用排饱和食盐水的方法收集,故D错误;
故选B.
点评 本题考查电化学的相关知识,涉及食盐水的电解和蒸发结晶,以及氯气的收集的知识,综合性强,但比较容易.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
1.室温下向10mL 0.1 mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )


| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
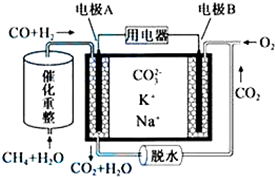

| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
10.氢氧化锂(LiAlH4)既是金属储氢材料又是有机合成中常用的试剂,溶于适量的水可得到无色溶液:LiAlH4+2H2O═LiAlO2+4H2↑,在125℃分解为LiH、H2和Al.下列说法不正确的是( )
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
17.用如图实验装置进行相应实验,装置正确且能达到实验目的是( )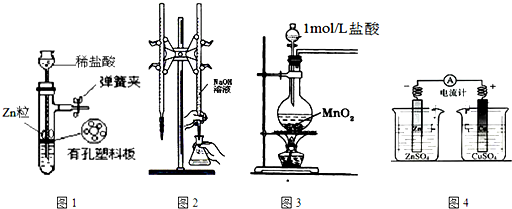

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
14.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图甲装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.(如图乙)下列说法错误的是( )
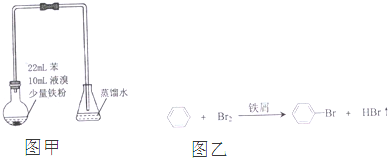

| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
11.对下列装置的叙述错误的是( )


| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
12. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
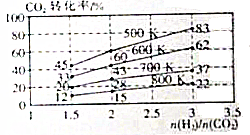
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正方向移动;
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.


 ,C
,C .
. .
. .
. 含苯环的所有同分异构体的结构简式:
含苯环的所有同分异构体的结构简式: .
.