题目内容
(12分)恒容容积为VL的密闭容器中发生2NO2  2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。

(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2  2NO2
2NO2

若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
(1)
B (2) K800℃ < K850℃
K800℃ < K850℃
(3)v(O2)= 1/40Vmol/(L-1·S-1)(4) BD (5) ①②③
【解析】VB>VA求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)=0.5V(NO2) v正(NO2)=v逆(NO)是平衡状态,浓度相等不是平衡状态。M=m/n m不变n变大摩尔质量不变就是平衡状态。密度=质量/体积 质量、体积一直不变,密度不是平衡状态的标志。温度升高平衡向逆反应方向移动,C(NO)变大。③体积可变,相当于减压往逆向移动但是浓度与体积有关,W(NO)变小。

 同步奥数系列答案
同步奥数系列答案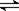 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
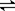 2NO2
2NO2
 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。

 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
