题目内容
【题目】![]() 是制备电池的重要原料。室温下,
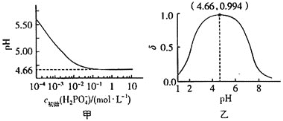
是制备电池的重要原料。室温下,![]() 溶液的pH随
溶液的pH随![]() 的变化如图甲所示,
的变化如图甲所示,![]() 溶液中
溶液中![]() 的分布分数
的分布分数![]() 随pH的变化如图乙所示
随pH的变化如图乙所示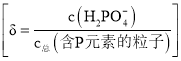 。
。
下列有关![]() 溶液的叙述正确的是
溶液的叙述正确的是 ![]()
![]()
A.溶液中存在3个平衡
B.含P元素的粒子有![]() 、
、![]() 和
和![]()
C.随![]() 增大,溶液的pH明显变小
增大,溶液的pH明显变小
D.用浓度大于![]() 的
的![]() 溶液溶解
溶液溶解![]() ,当pH达到
,当pH达到![]() 时,
时,![]() 几乎全部转化为
几乎全部转化为![]()
【答案】D
【解析】
A. ![]() 溶液中存在
溶液中存在![]() 的电离平衡和水解平衡、
的电离平衡和水解平衡、![]() 的电离平衡、
的电离平衡、![]() 的电离平衡,故A错误;
的电离平衡,故A错误;
B. ![]() 溶液中含P元素的粒子有
溶液中含P元素的粒子有![]() 、
、![]() 、
、![]() 和
和![]() ,故B错误;
,故B错误;
C.![]() 溶液的pH随着
溶液的pH随着![]() 初始浓度的增大逐渐减小,但当
初始浓度的增大逐渐减小,但当![]() 的浓度增大到10
的浓度增大到10![]() 时,浓度再增大,溶液的pH基本不变,故C错误;
时,浓度再增大,溶液的pH基本不变,故C错误;
D. ![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ,因为
,因为![]() 浓度大于1
浓度大于1 ![]() ,则可得到
,则可得到![]() 浓度也大于1
浓度也大于1 ![]() 。根据图1可知:当
。根据图1可知:当![]() 的浓度大于1
的浓度大于1 ![]() 时其
时其![]() ;根据图2可知当
;根据图2可知当![]() 时
时![]() 的分布分数达到
的分布分数达到![]() ,即
,即![]() 几乎全部转化为
几乎全部转化为![]() ,故D正确。
,故D正确。
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D