题目内容
5.常温下,取0.2mol•L-1HCl溶液与0.2mol•L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:(1)混合溶液中由水电离出的c(H+)>0.2mol•L-1HCl溶液中由水电离出的c(H+)(填“>、<或=”).
(2)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH>7(填“>、<或=”).
分析 (1)如MOH为强碱,则室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),pH应为7,而测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
(2)pH=3的盐酸,c(H+)=0.001mol/L,而一水合氨为弱碱,pH=11的氨水,一水合氨的浓度大于0.001mol/L.
解答 解:(1)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
(2)pH=3的盐酸,c(H+)=0.001mol/L,而一水合氨为弱碱,pH=11的氨水,一水合氨的浓度大于0.001mol/L,等体积混合后一水合氨过量,则反应后为氯化铵与一水合氨的混合物,溶液显碱性,则pH>7,故答案为:>.
点评 本题考查酸碱混合溶液pH的定性判断,为高频考点,把握pH与浓度的关系、电解质的强弱与盐类水解等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.分类是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据物质能否导电将化合物分为电解质和非电解质.
①根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据物质能否导电将化合物分为电解质和非电解质.
| A. | ①② | B. | ①③ | C. | ② | D. | ①②③ |
16.实验室要用固体氯化钠试剂准确配制500mL 0.2mol•L-1的NaCl溶液,下列哪种仪器一定用不到的是( )
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 试管 | D. | 托盘天平 |
17.有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2;②KCl;③NaOH;④CuSO4;⑤Na2SO4.如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开,则在下列的鉴别顺序中,最合理的是( )
| A. | ④③①⑤② | B. | ①④③⑤② | C. | ①⑤③④② | D. | ③④①⑤② |
14.下列叙述错误的是( )
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. |  N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |
15.下列同组中的两种物质,属于官能团异构的是( )
| A. | CH3CH2CH2OH和 CH3CH(OH)CH3 | |
| B. | CH3CH(CH3)2和CH3CH2CH2CH3 | |
| C. | CH3CH2OH和CH3OCH3 | |
| D. | CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
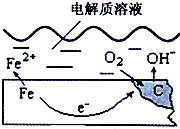 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为: