题目内容
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol∕L、2.00mol∕L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填空:
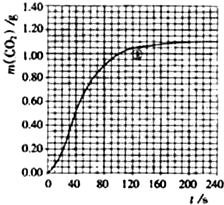
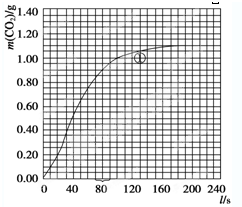
(2)实验①中CO2质量随时间变化的关系见下图.计算实验①中70s-90s范围内用HNO3表示的平均反应速率

(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究 固体的表面积 固体的表面积 对反应速率的影响; |
| ② | 25 25 |
粗颗粒 粗颗粒 |
1.00 1.00 | |
| ③ | 35 35 |
粗颗粒 粗颗粒 |
2.00 2.00 | |
| ④ | 25 25 |
细颗粒 细颗粒 |
2.00 2.00 |
0.01mol∕(L?s)
0.01mol∕(L?s)
(忽略溶液体积变化,不需要写出计算过程).
分析:(1)根据实验的目的和影响化学反应速率的因素来设计实验;
(2)由CO2质量随时间变化的关系图得出70-90s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在70-90s范围内HNO3的平均反应速率.
(2)由CO2质量随时间变化的关系图得出70-90s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在70-90s范围内HNO3的平均反应速率.
解答:解:(1)由实验目的可知,探究浓度、接触面积对化学反应速率的影响,
实验①和②探究浓度对反应速率的影响,则实验①②的温度、大理石规格相同,只有浓度不同;实验①和③探究温度对反应速率的影响,则实验①③中只有温度不同;而实验①④中只有大理石规格不同,
故答案为:
(2)由图可知70s二氧化碳质量为0.84g,90s生成二氧化碳质量为0.95g,70-90sCO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,二氧化碳的物质的量为n(CO2)=0.0025mol,
由反应方程式
CaCO3+HNO3═
Ca(NO3)2+
CO2↑+
H2O可知,消耗HNO3的物质的量为:n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=
=0.2mol?L-1,反应的时间为:t=90s-70s=20s
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=
=0.01mol∕(L?s),
故答案为:0.01mol∕(L?s).
实验①和②探究浓度对反应速率的影响,则实验①②的温度、大理石规格相同,只有浓度不同;实验①和③探究温度对反应速率的影响,则实验①③中只有温度不同;而实验①④中只有大理石规格不同,
故答案为:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | (Ⅲ)物质的固体表面积 | |||
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
由反应方程式
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=
| 0.005mol |
| 0.025L |
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=
| △c |
| △t |
故答案为:0.01mol∕(L?s).
点评:本题考查了化学反应速率的影响因素及反应速率的计算,合理分析题中信息及图象变化是解答本题的关键,较好的考查了学生综合应用知识的能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式
CaCO3+HNO3=
Ca(NO3)2+
CO2↑+
H2O,计算实验①在70-90s范围内HNO3的平均反应速率为(忽略溶液体积变化,) (图中70-90s间CO2的质量增加了0.1g)
(3)预期实验结果是(比较三组实验速率的快慢,用代号) 、 、 .
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(3)预期实验结果是(比较三组实验速率的快慢,用代号)

 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.