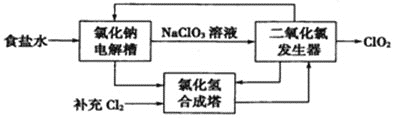
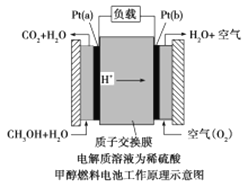
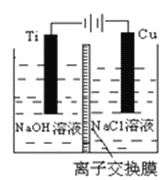
题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列有关含氮物质的问题:
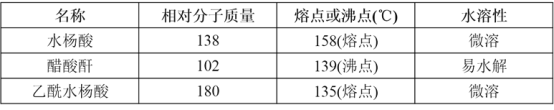
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是________![]() 填序号
填序号![]() 。
。
A.容器内混合气体颜色不再变化 ![]() 容器内的压强保持不变
容器内的压强保持不变
C.v逆(NO2)=v正(NO) ![]() 容器内混合气体密度保持不变
容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)2NO(g) H>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应的正反应速率和逆反应速率的关系:v正_____v逆(填“>”、“<”或“=”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2=N2+2H2O。该电池放电时,负极的电极反应式是______________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式____________。
【答案】NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ/mol BD > N2H4+4OH- - 4e- =N2↑+4H2O N2H62++H2O[N2H5H2O]++H+
【解析】
(1)根据图像判断焓变,再写热化学方程式;
A.容器内混合气体颜色不再变化时,则气体浓度不变,达到平衡;
B.该反应为气体气体的总物质的量不变,则容器内压强不变,压强不能判断反应达到平衡;
C.化学反应速率之比等于化学计量数之比,反应到达平衡,同一物种的正逆反应速率相等,v逆(NO2)=v正(NO),达到平衡状态;
D.恒容体积不变,混合气体的质量不变,则容器内混合气体密度始终不变,密度不能说明反应到达平衡;
(2)根据Qc与K的关系判断;
(3)负极失电子,发生氧化反应,生成氮气;
(4)由N2H6Cl2与NH4Cl类似推测。
(1)由图可知,1molNO2和1molCO反应生成CO2和NO放出热量234kJ,则NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ/mol;
A.容器内混合气体颜色不再变化时,气体浓度不变,达到平衡,与题意不符,A错误;
B.该反应为气体气体的总物质的量不变,则容器内压强不变,压强不能判断反应达到平衡,符合题意,B正确;
C.化学反应速率之比等于化学计量数之比,反应到达平衡,同一物种的正逆反应速率相等,v逆(NO2)=v正(NO),达到平衡状态,与题意不符,C错误;
D.恒容体积不变,混合气体的质量不变,则容器内混合气体密度始终不变,密度不能说明反应到达平衡,符合题意,D正确;
答案为BD;
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,Qc=![]() =9×10-4<K,则反应应向正反应方向进行,则v正大于v逆;
=9×10-4<K,则反应应向正反应方向进行,则v正大于v逆;
(3)肼--空气燃料电池是一种碱性燃料电池工作时,负极发生氧化反应,负极反应式为N2H4+4OH- - 4e- =N2↑+4H2O;
(4)由N2H6Cl2与NH4Cl类似,而N2H4是二元碱而NH3是一元碱,则盐酸肼第一步水解反应的离子方程式为N2H62++H2O[N2H5H2O]++H+。

【题目】实验室制乙酸乙酯的主要装置如图所示:
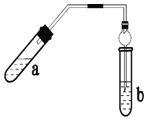
主要步骤:
①在 a 试管中 按 2:3:2 的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按 A 图连接装置,使产生的蒸气经导管通到 b 试管所盛的饱和碳酸钠溶液中;
③小火加热 a 试管中 的混合液;
④等 b 试管中收集到约 2mL 产物时停止加热。撤下 b 试管并用力振 荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
⑴实验室配制混合物加入试剂顺序:______。
⑵步骤![]() 中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
⑶A 装置中使用球形干燥管除起到冷凝作用外,另一重要作用是______,步骤![]() 中分离乙 酸乙酯必须使用的一种仪器是______。
中分离乙 酸乙酯必须使用的一种仪器是______。
⑷为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图 A 所示装置进行了以下 4 个实验。实验开始先用酒精灯微热 3min,再加热使之微微沸腾 3min。实验结束后充分振荡小试管 b 再测 有机层的厚度,实验记录如下:
实验编号 | 试管 a 中试剂 | 试管 b 中试剂 | 测得有机层的厚度/cm |
W | 3mL 乙醇、2mL 乙酸、2mL 18mol/L 浓硫酸 | 饱和 Na2CO3 溶液 | 5.0 |
X | 3mL 乙醇、2mL 乙酸 | 0.1 | |
Y | 3mL 乙醇、2mL 乙酸、2mL3mol/LH2SO4 | 1.2 | |
Z | 3mL 乙醇、2mL 乙酸、盐酸 | 1.2 |
①实验 Y 的目的是与实验 Z 相对照,证明H+ 对酯化反应具有催化作用。实验 Z 中应加入盐酸的体积 和浓度分别是______mL 和______mol/L
②分析实验______![]() 填实验编号
填实验编号![]() 的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为______![]() 填字母
填字母![]() 。
。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH 固体
【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)=N2O4(l) ΔH1;
②N2(g)+2H2(g)=N2H4(g) ΔH2;
③O2(g)+2H2(g)=2H2O(g) ΔH3;
④2N2H4(g)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4 =___________(用含ΔH1、ΔH2、ΔH3的代数式表示)
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 0.6 | 3 |
3 | 900 | a | b | c | d | t |
① 该反应为________(填“吸热”或“放热”)反应;实验2的平衡常数K= _________。
② 若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4mol H2O(g),使反应达到新平衡,下列说法不正确的是_______。
A.新旧平衡时容器气体压强之比为5:3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-1
D.新旧平衡时容器气体密度之比为5:3
(3)室温下,用0.1 mol·L-1的KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
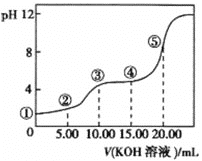
①点②所示的溶液中的电荷守恒式为_____________。
②点③所示溶液中各离子浓度由大到小的顺序为___________。
③点④所示溶液中c(K+) + c(H2C2O4 ) + c(![]() ) + c(
) + c(![]() ) =_______ mol·L-1。
) =_______ mol·L-1。