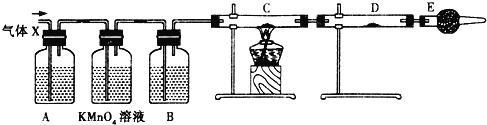
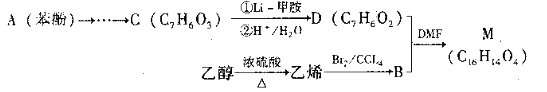
题目内容
【题目】下列离子方程式书写正确的是( )
A.在NaClO溶液中通入过量SO2气体:ClO﹣+H2O+SO2═HClO+HSO ![]()
B.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O
C.NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH﹣+2HCO ![]() ═CaCO3↓+2H2O+CO
═CaCO3↓+2H2O+CO ![]()
D.10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH﹣+2Al3++3SO ![]() ═3BaSO4↓+2Al(OH)3↓
═3BaSO4↓+2Al(OH)3↓
【答案】C
【解析】解:A.次氯酸能够氧化二氧化硫,正确的离子方程为:2ClO﹣+2H2O+2SO2═2SO42﹣+4H++2Cl﹣ , 故A错误;B.反应生成的铁离子能够氧化碘离子,正确的离子方程式为:2I﹣+Fe2O3+6H+=2Fe2++3H2O+I2 , 故B错误;
C.NaHCO3与少量的Ca(OH)2溶液反应生成碳酸钙和碳酸钠,反应的离子方程式为:Ca2++2OH﹣+2HCO ![]() ═CaCO3↓+2H2O+CO
═CaCO3↓+2H2O+CO ![]() ,故C正确;
,故C正确;
D.10mL 0.5mol/L的明矾溶液中含有0.005mol,含有0.01mol硫酸根离子和0.005mol铝离子;20mL 0.5mol/L Ba(OH)2溶液中含有0.01mol,含有0.01mol钡离子和0.02mol氢氧根离子,硫酸根与钡离子恰好反应生成硫酸钡沉淀,而氢氧根离子恰好与铝离子反应生成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH﹣+Al3++2SO ![]() ═2BaSO4↓+AlO
═2BaSO4↓+AlO ![]() +2H2O,故D错误;
+2H2O,故D错误;
故选C.

【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3﹣、Cl﹣、NO | 不能大量共存, |
B | 由水电离出的H+浓度为1×10﹣12molL﹣1 | NH4+、Na+、NO | 一定能大量共存,NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO | 不能大量共存,5Fe2++MnO4﹣+8H+═Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO﹣、SO | 不能大量共存,2ClO﹣+SO2+H2O═2HClO+SO |
A.A
B.B
C.C
D.D